
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
| 食物 | 苹果 | 葡萄 | 牛奶 | 玉米 |
| PH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 6.8~8.0 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
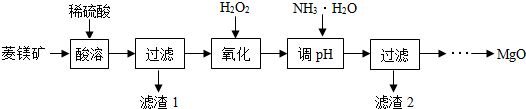
| Mg2+ | Fe2+ | Fe3+ | |
| 开始沉淀 | 9.4 | 7.9 | 2.7 |
| 沉淀完全 | 12.4 | 9.6 | 3.7 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
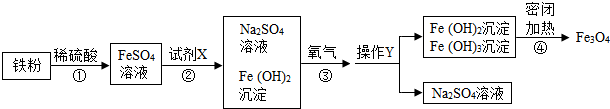
查看答案和解析>>
科目: 来源: 题型:实验探究题
 某制备氢气新工艺的主要流程如下:
某制备氢气新工艺的主要流程如下:查看答案和解析>>
科目: 来源: 题型:实验探究题
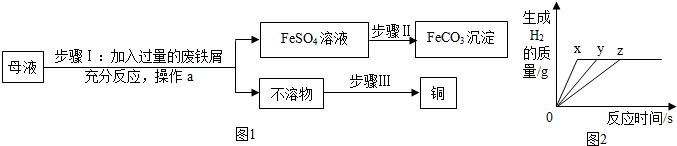
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com