
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:解答题
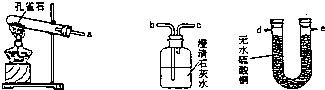
 在生活和化学实验中,人们经常用到各种除湿剂(即干燥剂).
在生活和化学实验中,人们经常用到各种除湿剂(即干燥剂).
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
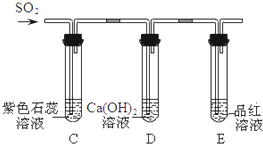 初中化学中我们学习了二氧化碳的性质,二氧化硫与二氧化碳均属于非金属氧化物,是否具有相似的化学性质呢?
初中化学中我们学习了二氧化碳的性质,二氧化硫与二氧化碳均属于非金属氧化物,是否具有相似的化学性质呢?查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
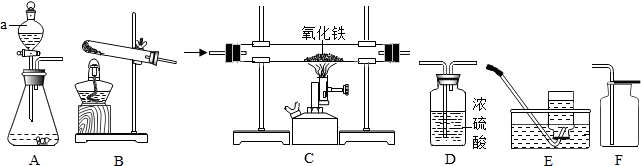
查看答案和解析>>
科目: 来源: 题型:实验探究题
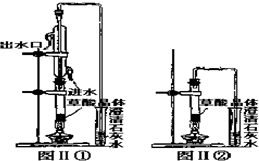 小丽喜食豆腐,今天,小丽让妈妈为她做菠菜炒豆腐,可小丽的妈妈却告诉她菠菜不能与豆腐同食.
小丽喜食豆腐,今天,小丽让妈妈为她做菠菜炒豆腐,可小丽的妈妈却告诉她菠菜不能与豆腐同食.| 实验步骤 | 实验现象 | 实验结论 |
| ①将菠菜在少量开水中煮沸2min~3min,取1mL~2mL滤液于试管中,丙滴加少量CaSO4或CaCl2溶液 | 产生白色沉淀 | 有草酸钙生成 |
| ②在步骤①的沉淀物中加入过量稀盐酸 | 沉淀部分溶解且产生气泡 | 被溶解的沉淀一定不是CaC2O4 |
| 实验步骤 | 实验现象 | 实验结论 |
| ③将步骤②产生的气体通入澄清的石灰水中 | 澄清的石灰水变浑浊 | 产生的气体是CO2步骤②被溶解的沉淀是碳酸钙 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 某组同学在学习盐的性质时,将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的探究.
某组同学在学习盐的性质时,将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的探究.| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加无色酚酞试液 | 溶液变红色 | 猜想①正确. |
| 实验操作 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气体产生 | “猜想一”不成立 |
| 实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液, B中加入Na2CO3溶液 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
若A中没有沉淀,B中产生白色沉淀 | “猜想二”成立 | |
若A、B两支试管中都没有沉淀产生 | “猜想三”成立 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com