
科目: 来源: 题型:解答题
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有少量Fe2CO3的试管中分别加入NaCl溶液和Na2SO4溶液,振荡 | 固体不溶解 | ${SO}_{4}^{2-}$或Cl-不能使Fe2O3溶解;H2O分子不能使Fe2O3溶解 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
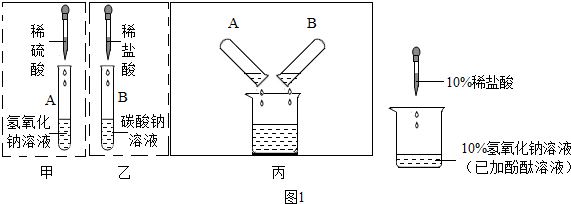
 学习碱的化学性质后,我们知道碱能与某些非金属氧化物反应.老师将二氧化碳通入氢氧化钠溶液中,但未看到明显现象,同学们分小组设计实验证明反应发生.下面是某一小组的交流过程:
学习碱的化学性质后,我们知道碱能与某些非金属氧化物反应.老师将二氧化碳通入氢氧化钠溶液中,但未看到明显现象,同学们分小组设计实验证明反应发生.下面是某一小组的交流过程:| 实验步骤 | 实验现象 | 结论 |
| 取NaOH溶液于试管中,向其中通入CO2,再向其中加入稀盐酸. | 有气泡生成 | 二氧化碳与氢氧化钠发生反应 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
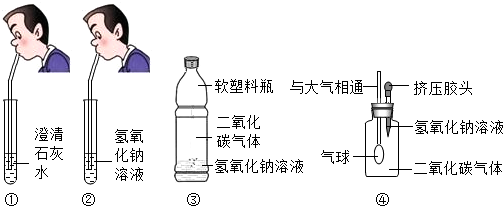
| 实验步骤 | 实验现象 | 实验结论 |
| 取(3)实验后的溶液少许,再向其中加CaCl2(或BaCl2) | 出现白色沉淀 | 验证了二氧化碳和氢氧化钠溶液反应 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
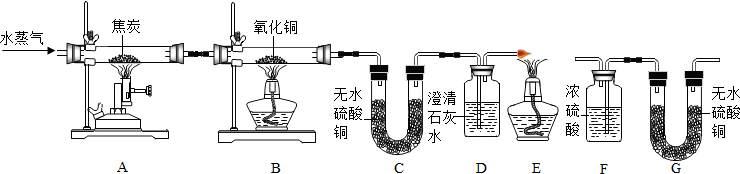
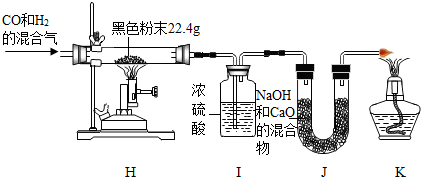
查看答案和解析>>
科目: 来源: 题型:实验探究题
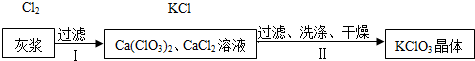
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
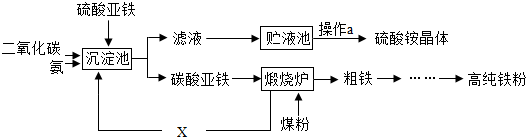
| 实验步骤 | 实验现象 | 实验结论 |
| 样品为铵态氮肥 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
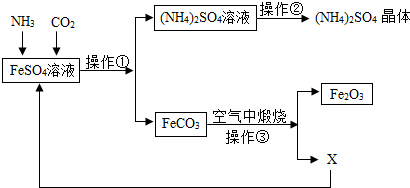
查看答案和解析>>
科目: 来源: 题型:实验探究题
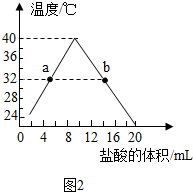
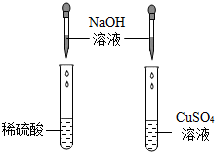 某化学兴趣小组的同学在探究碱与酸、碱反应的性质时做了如图两个实验.
某化学兴趣小组的同学在探究碱与酸、碱反应的性质时做了如图两个实验.| 实验步骤 | 实验现象 | 实验结论 |
| 取少量烧杯内的液体于试管中,并加入少量氧化铜固体 | 黑色固体溶解 | 小华观点正确 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 结论 |
| ①用试管取少量蒸馏水,滴入1-2滴无色酚酞试液 | 试管内溶液不变色 | 猜想1不成立 |
| ②用试管取少量KCl溶液,滴入1-2滴无色酚酞试液 | 试管内溶液不变色 | 猜想2不成立 |
| ③用试管取少量氢氧化钾溶液,滴入1-2滴无色酚酞试液 | 试管内溶液变红 | 猜想3成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com