
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:解答题
| 解:68g过氧化氢中氧元素的质量为:68g×$\frac{20}{{H}_{2}{O}_{2}}$×100%=68g×$\frac{32}{34}$=64g,因为 氧气中的氧元素来自于过氧化氢,所以68g过氧化氢产生氧气的质量为64g. |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.| 操作步骤 | 实验现象 | 实验结论 |
| 取少量黄色固体于试管中,加入适量的水,并将湿润的红色石蕊试纸放在试管口 | 试管中有气体产生,湿润的红色石蕊试纸变蓝 | 黄色固体为Mg3N2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:推断题
 已知A、B、C、D、E是初中化学常见的五种不同物质,其中A在空气中的含量为21%,B在常温下为液体,A→E反应剧烈,火星四射,且E是一种黑色固体.(说明:“-”反应关系,“→”转化关系).根据如图所示回答下列问题:
已知A、B、C、D、E是初中化学常见的五种不同物质,其中A在空气中的含量为21%,B在常温下为液体,A→E反应剧烈,火星四射,且E是一种黑色固体.(说明:“-”反应关系,“→”转化关系).根据如图所示回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 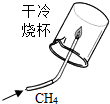 既说明甲烷具有可燃性,又说明甲烷是由氢元素和碳元素组成 | |
| B. |  既说明二氧化碳的密度比空气大,又说明二氧化碳不能燃烧也不支持燃烧 | |
| C. | 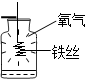 既说明铁丝具有可燃性,又说明增大氧气的浓度能促进燃烧 | |
| D. |  既说明二氧化碳可溶于水,又说明二氧化碳能与水反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同时生成D的质量是9克 | |
| B. | B与D的相对分子质量之比是8:1 | |
| C. | 参加反应的A与生成C的质量之比是8:11 | |
| D. | 若A的相对分子质量是32,则C的相对分子质量是44 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com