
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验一 | 实验二 |
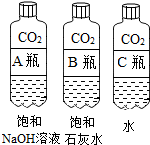 | 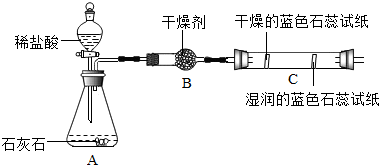 |
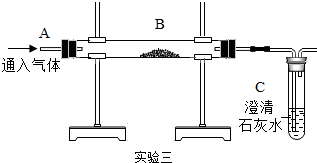
| 实验四 | |
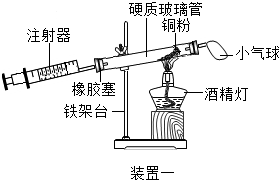 | 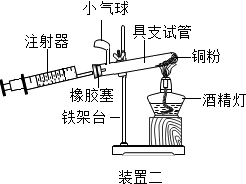 |
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL | 16% |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
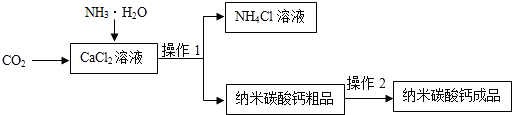
查看答案和解析>>
科目: 来源: 题型:实验探究题
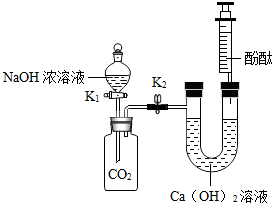 某化学兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2.
某化学兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2.| 实 验 步 骤 | 实 验 现 象 | 实 验 结 论 |
| ①取滤液样品于试管中,加入足量的盐酸; | 若有气泡冒出,且红色消失 | 原废液中的溶质为: Na2CO3和NaOH; |
| ②另取滤液样品于试管中,加入Na2CO3溶液. | 若有白色沉淀出现,红色不消失 | 原废液中的溶质为: Ca(OH)2和NaOH. |
查看答案和解析>>
科目: 来源: 题型:实验探究题
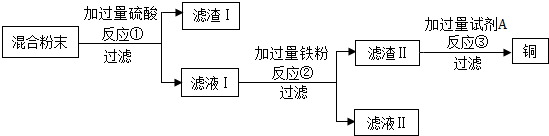
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:推断题
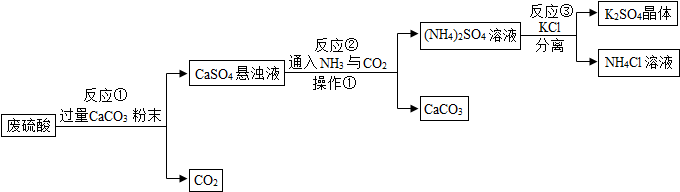
查看答案和解析>>
科目: 来源: 题型:解答题
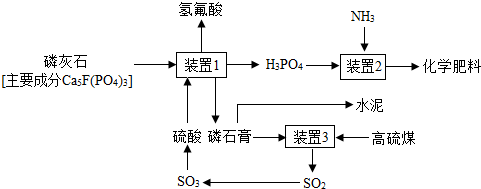
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com