
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 加NaOH溶液体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 解释与结论 |
| 分别取三支试管,向其中加入等质量、等浓度的稀硫酸,然后将铝、铬、铜三种金属片分别插入三支试管中. | 铝片表面产生气泡较快; 铬片表面产生气泡较缓慢,溶液变蓝色; 铜片无明显现象. | 猜想二成立. 铬与稀硫酸反应生成蓝色的硫酸亚铬 (CrSO4)溶液,该反应的化学方程式为Cr+H2SO4=CrSO4+H2↑. |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.
某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.| 实验步骤 | 实验现象 | 实验结论 |
| 待测液呈碱性,表明含有氢氧化钠. |
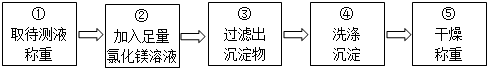
查看答案和解析>>
科目: 来源: 题型:解答题
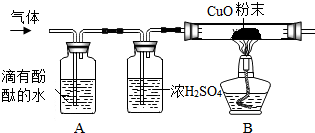 小明同学在实验室将镁放入NH4Cl溶液反应,发现有气泡产生.询问老师后得知镁与NH4Cl溶液反应能生成气体和一种盐.为了确定气体的成分,进行下列实验探究:
小明同学在实验室将镁放入NH4Cl溶液反应,发现有气泡产生.询问老师后得知镁与NH4Cl溶液反应能生成气体和一种盐.为了确定气体的成分,进行下列实验探究:查看答案和解析>>
科目: 来源: 题型:实验探究题
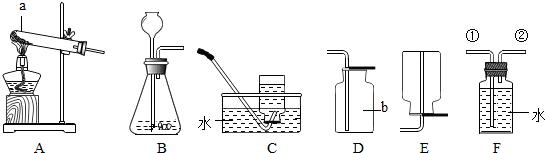
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 天然水和纯净水没有什么区别 | |
| B. | 过滤后的天然水就是蒸馏水 | |
| C. | 硬水和软水的区别在于水中有没有溶有钙、镁化合物 | |
| D. | 设法除去硬水中的钙、镁化合物.可以使硬水软化成软水. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com