2.镁及其化合物在生产、生活中有着广泛的应用前景.
(一)镁的广泛应用
(1)没有镁的存在,就不能形成叶绿素,也就没有光合作用,这里的镁是指B.
A.单质 B.元素 C.原子
(2)汽车轮胎由不锈钢丝、合成橡胶组成,氧化镁是轮胎的促进剂,可增强其硬度.
以上叙述中不涉及到C(选填序号).
A.合金 B.合成材料 C.无机非金属材料 D.复合材料
(3)金属镁可用于照明弹,因其燃烧时发出耀眼的强光.
(二)MgO的制备
工业上用白云石(含MgCO
3、CaCO
3)制取轻质氧化镁(MgO).主要流程如图1:
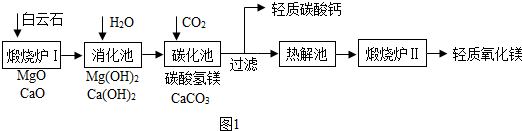
(1)写出煅烧炉Ⅰ中的一个化学反应方程式CaCO
3$\frac{\underline{\;高温\;}}{\;}$CaO+CO
2↑,或MgCO
3$\frac{\underline{\;高温\;}}{\;}$MgO+CO
2↑.
(2)碳化池的作用是将钙元素转化为沉淀,化学反应方程式是Ca(OH )
2+CO
2=CaCO
3↓+H
2O.
(3)消化池中会形成沸腾的乳浊液,沸腾的原因可能是氧化钙与水反应放热.
(4)碳酸氢镁的组成和性质与小苏打相似,则热解池中溶液的溶质化学式是Mg(HCO
3)
2.
(三)碱式碳酸镁组成测定
煅烧炉Ⅱ中物质是碱式碳酸镁【aMgCO
3•bMg(OH)
2•cH
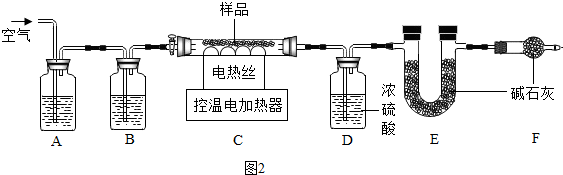
2O】,为确定其成分,做如图2实验(假设每步反应、吸收都完全):
【查阅资料】碱式碳酸镁受热分解生成MgO、CO
2、H
2O.
(1)装配好实验装置后,首先要检查装置气密性.
(2)A、B装置的作用是除去空气中的二氧化碳和水蒸气.洗气瓶B中应盛放a(选填序号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)现称取48.4g碱式碳酸镁在C装置中进行热分解,直至C装置中剩余固体质量不再变化为止,继续通空气至冷却.冷却后装置D增重10.8g,装置E增重17.6g.继续通一段时间空气的目的是使反应生成的水和二氧化碳被完全吸收.
(4)根据以上数据,则生成MgO质量是20g,a?b?c=4?1?5.
(5)若缺少F装置,测得的a值偏大(选填“偏大”、“偏小”、“不变”).



 如图是一种可用于集气、洗气等的多功能装置
如图是一种可用于集气、洗气等的多功能装置
 如图标志中
如图标志中