
科目: 来源: 题型:解答题
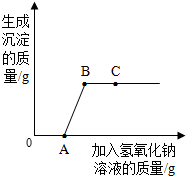 将氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,并根据观察到的现象绘制了如图曲线,根据图示回答问题:
将氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,并根据观察到的现象绘制了如图曲线,根据图示回答问题:查看答案和解析>>
科目: 来源: 题型:解答题
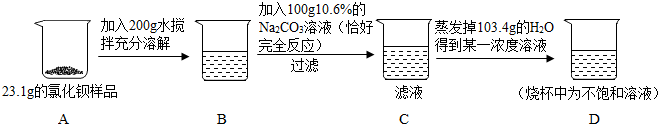
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
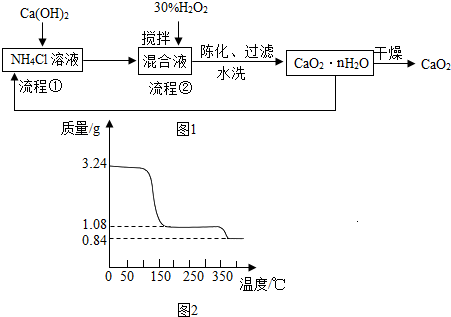
查看答案和解析>>
科目: 来源: 题型:解答题
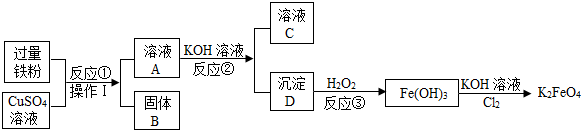
查看答案和解析>>
科目: 来源: 题型:解答题
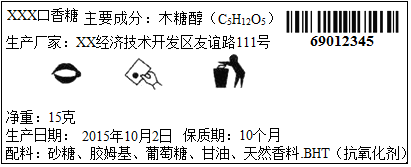
查看答案和解析>>
科目: 来源: 题型:实验探究题
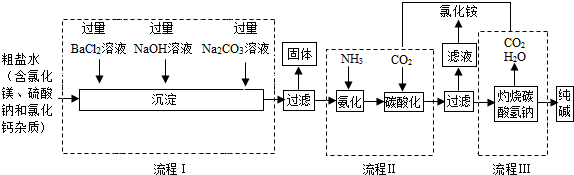
查看答案和解析>>
科目: 来源: 题型:选择题
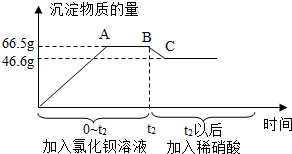 某碳酸钠固体样品中,可能含有硫酸钠、碳酸钙、硫酸铜、氯化钠、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:第一步:取50g该样品溶于水得到无色溶液;第二步:再向第一步得到的无色溶液中,先后逐滴加入过量氯化钡溶液和过量的稀硝酸.产生沉淀的物质的质量与时间的关系如图所示,下列说法正确的是( )
某碳酸钠固体样品中,可能含有硫酸钠、碳酸钙、硫酸铜、氯化钠、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:第一步:取50g该样品溶于水得到无色溶液;第二步:再向第一步得到的无色溶液中,先后逐滴加入过量氯化钡溶液和过量的稀硝酸.产生沉淀的物质的质量与时间的关系如图所示,下列说法正确的是( )| A. | 由第一步实验可知,原样品中一定没有硫酸铜 | |
| B. | BC段减少的沉淀是碳酸钙和碳酸钡 | |
| C. | 杂质一定含有硫酸钠、氯化钠 | |
| D. | 第二步实验结束后,最终所得溶液中的溶质共有三种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com