
科目: 来源: 题型:选择题
| A. | 建立假设 | B. | 收集证据 | C. | 实验 | D. | 做出结论 |
查看答案和解析>>
科目: 来源: 题型:解答题
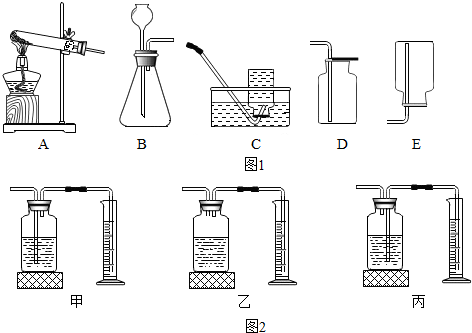
查看答案和解析>>
科目: 来源: 题型:解答题
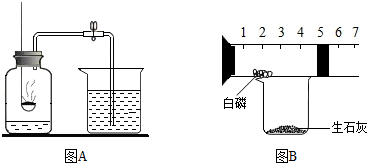
查看答案和解析>>
科目: 来源: 题型:实验探究题
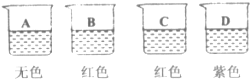
查看答案和解析>>
科目: 来源: 题型:填空题
| A.物质组成的差异性决定物质性质的差异性 | B.实验安全注意事项 |
| 金刚石与石墨---元素种类不同 一氧化碳与二氧化碳---分子构成不同 | 制取气体-先检查装置的气密性 点燃可燃性气体-先检验气体的纯度 |
| C.化学物质中的“三” | D.化学物质与俗名 |
| 三大化石燃料-煤、石油、天然气 三种黑色物质-氧化铜、二氧化锰、三氧化二铁 | 氧化钙-生石灰 碳酸钠-纯碱 |
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
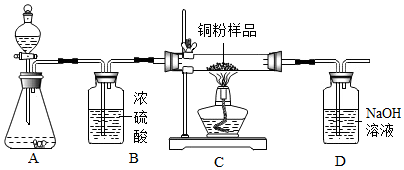 某化学兴趣小组用过氧化氢溶液(MnO2作催化剂)制取干燥的氧气,并用来测定10g某铜粉样品(含杂质碳)中铜的质量分数,实验装置如图所示.
某化学兴趣小组用过氧化氢溶液(MnO2作催化剂)制取干燥的氧气,并用来测定10g某铜粉样品(含杂质碳)中铜的质量分数,实验装置如图所示.| 实验操作 | 实验现象 | 分析及结论 |
| 实验一:将带火星的木条伸入盛有5mL5%H2O2溶液的试管 | 带火星的木条不能复燃 | H2O2溶液常温下产生氧气的量很少,不足以使带火星的木条复燃 |
| 实验二:向盛有5mL5%H2O2溶液的试管中加入1g氧化铜固体,将一根带火星的木条伸入试管 | 产生大量气泡,带火星的木条复燃 | 氧化铜能够加快过氧化氢的分解速率 |
| 实验三: 向盛有5mL5%H2O2溶液的试管中加入1g铜粉,将一根带火星的木条伸入试管 | 带火星的木条不能复燃 | 猜想Ⅱ不成立 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 猜想1 | 猜想2 | 猜想3 |
| 只有CO | 只有CO2 | CO和CO2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com