
科目: 来源: 题型:实验探究题
| 燃料 | 沸点(℃) | 燃烧放热(kJ/g) | 相对分子质量 | 爆炸极限 | 液态密度(g/cm3) |
| 氢 | -252.6 | 119.20 | 2.0 | 4.0%~75.6% | 0.07 |
| 氨 | -33.50 | 18.65 | 17.0 | 16%~25% | 0.61 |
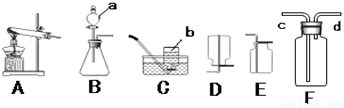
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
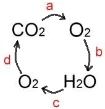 “水循环”、“氧循环”和“碳循环”是自然界存在的三大重要循环.结合你所学到的化学知识回答下面有关问题.
“水循环”、“氧循环”和“碳循环”是自然界存在的三大重要循环.结合你所学到的化学知识回答下面有关问题.查看答案和解析>>
科目: 来源: 题型:解答题
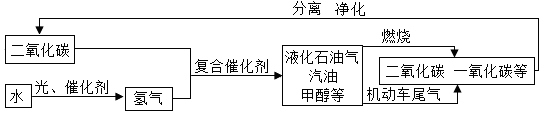
查看答案和解析>>
科目: 来源: 题型:实验探究题
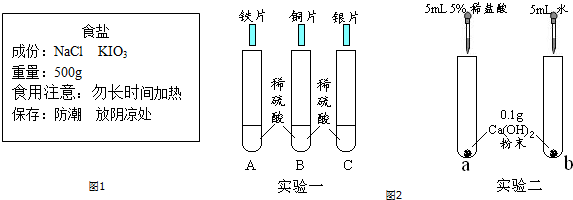
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 操作 | 现象 | 结论 |
| 取洗净后的白色固体,加入足量的稀盐酸 | 观察到产生气泡 | 白色固体一定含有MgCO3 |
| 秤取一定量白色固体,充分加热至不再产生气体,将产生的气体先通入碱石灰,再通入浓硫酸,分别称量装置反应前后的质量 | 碱石灰增重,浓硫酸不变 | 白色固体不含有Mg(OH)2 |
查看答案和解析>>
科目: 来源: 题型:推断题
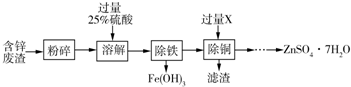
查看答案和解析>>
科目: 来源: 题型:推断题
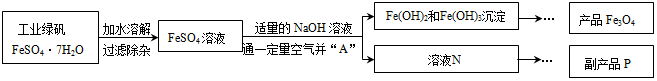
查看答案和解析>>
科目: 来源: 题型:实验探究题
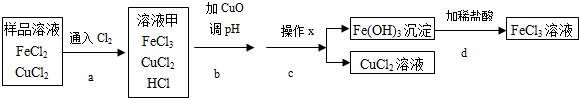
| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com