
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量反应后的溶液于试管中,加入锌粒 | 没有气泡产生. | 两种物质恰好完全反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
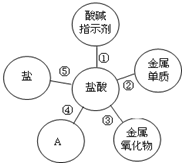 归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质(如图所示,连线表示相互反应).
归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质(如图所示,连线表示相互反应).查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
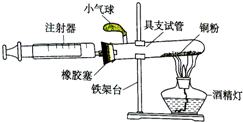 某化学兴趣小组在实验室利用自己设计的装置(如图)测定空气中氧气的含量.
某化学兴趣小组在实验室利用自己设计的装置(如图)测定空气中氧气的含量.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

 ,写离子符号S2-,该元素的原子核外有3个电子层,它属于非金属元素(填“金属”或“非金属”),在化学反应中易得到(填“得到”或“失去”)电子.
,写离子符号S2-,该元素的原子核外有3个电子层,它属于非金属元素(填“金属”或“非金属”),在化学反应中易得到(填“得到”或“失去”)电子.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com