
科目: 来源: 题型:解答题
 物质A、B、C之间有如图所示的转化关系(部分物质和反应条件已经略去).
物质A、B、C之间有如图所示的转化关系(部分物质和反应条件已经略去).查看答案和解析>>
科目: 来源: 题型:选择题
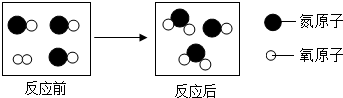
| A. | 反应前后分子数目改变 | B. | 反应前后元素种类不变 | ||
| C. | 反应前后的质量比为45:16 | D. | 反应前后氮元素化合价发生改变 |
查看答案和解析>>
科目: 来源: 题型:解答题
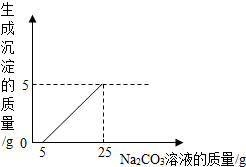 刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.
刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.查看答案和解析>>
科目: 来源: 题型:实验探究题
| 猜想 | 实验操作 | 实验现象 | 结论 |
| A | 取过氧化钠与水反应后的溶液放入试管中, 加入适量二氧化锰后,把带火星的木条放在试管口 | 带火星的木条复燃 | 猜想A 正确 |
| B | 取过氧化钠与水反应后的溶液放入试管中, 加入足量的水后,滴加酚酞试液 | 溶液变红,过了一会,红色又褪去了 | 猜想B 错误 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 伊伐布雷定属于有机化合物 | B. | 伊伐布雷定分子由70个原子构成 | ||
| C. | 伊伐布雷定由4种元素组成 | D. | 伊伐布雷定的相对分子质量为468 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
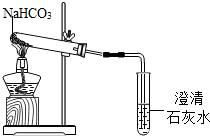 碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小红同学设计实验对碳酸氢钠的性质进行了探究.请你参与她的探究活动.
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小红同学设计实验对碳酸氢钠的性质进行了探究.请你参与她的探究活动.查看答案和解析>>
科目: 来源: 题型:实验探究题
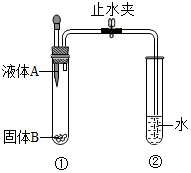 如图所示装置进行实验:当打开止水夹,挤压滴管将液体A滴入试管①时,观察到试管②有气泡产生.
如图所示装置进行实验:当打开止水夹,挤压滴管将液体A滴入试管①时,观察到试管②有气泡产生.查看答案和解析>>
科目: 来源: 题型:解答题
 “防治碘缺乏病日”的主题是“坚持食用碘盐,预防出生缺陷”.据了解,有些偏远地区不少人受到碘缺乏病威胁,这是源于碘盐每500克售价1.2元,不加碘的私盐往往0.5元就卖.巨大的利润驱使不法分子走街串巷,将这些非碘盐直销到偏远地区、农村.
“防治碘缺乏病日”的主题是“坚持食用碘盐,预防出生缺陷”.据了解,有些偏远地区不少人受到碘缺乏病威胁,这是源于碘盐每500克售价1.2元,不加碘的私盐往往0.5元就卖.巨大的利润驱使不法分子走街串巷,将这些非碘盐直销到偏远地区、农村.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com