
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验探究题

| 反应前 | 氧化铜完全反应后 | |
| Ⅰ组 | 洗气瓶和石灰水的质量为185g | 洗气瓶和瓶内物质的总质量为187g |
| Ⅱ组 | 玻璃管和氧化铜样品的质量为57.9g | 玻璃管和玻璃管内物质的质量为56.1g |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 某同学在实验室的试剂柜中发现一瓶失去标签的无色溶液,可能是硝酸、硝酸镁、硝酸铁、硝酸钾中的一种,为了确定该药品,进行下列实验:
某同学在实验室的试剂柜中发现一瓶失去标签的无色溶液,可能是硝酸、硝酸镁、硝酸铁、硝酸钾中的一种,为了确定该药品,进行下列实验:查看答案和解析>>
科目: 来源: 题型:实验探究题

| 物质 | K2CO3 | K2SO | KMnO4 |
| 溶解度/g | 111 | 11.1 | 6.34 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:推断题
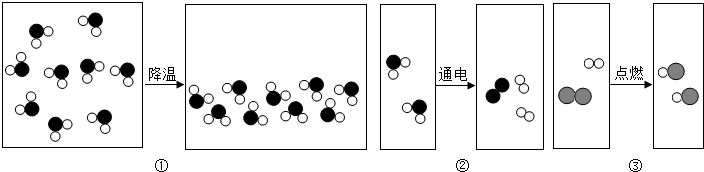
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验目的 | 实验方案 | ||
| 实验① | 实验② | ||
| A. | 探究Zn、Fe、Cu 的活动性强弱 |  |  |
| B. | 探究温度对反应剧烈程度的影响 |  |  |
| C. | 探究催化剂对反应快慢的影响 |  |  |
| D. | 探究CO2 的物理性质和化学性质 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeTiO3中Fe、Ti、O 元素的质量比是56:48:16 | |
| B. | FeTiO3的相对分子质量是56+48+16 | |
| C. | FeTiO3中Fe、Ti、O 的原子个数比是1:1:1 | |
| D. | FeTiO3中Ti 元素的质量分数是$\frac{48}{56+48+16×3}$×100% |
查看答案和解析>>
科目: 来源: 题型:选择题
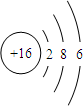
| A. | 该原子的核内电子数为16 | B. | 该原子最外电子层达到了稳定结构 | ||
| C. | X 属于非金属元素 | D. | X 与Na 生成化合物NaX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com