
科目: 来源: 题型:选择题
| A. | 无法确定被称量物的质量 | B. | 可确定称量物的质量为9.8g | ||
| C. | 可确定称量物的质量为8.2g | D. | 此操作可确定称量物的质量为9.0g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 道尔顿和汤姆生等科学家研究得出了重要的结论“物质是由原子或分子构成的” | |
| B. | 1869年,俄国化学家门捷列夫发现了元素周期律和元素周期表 | |
| C. | 原子论和分子学说的创立,奠定了现代化学的基础 | |
| D. | 20世纪末,人类发现和合成的物质超过4000万种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 物质名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
| 沸点 (℃) | -88.6 | -42.2 | -0.5 | 36.1 | 69.2 |
| A. | 乙烷、丙烷和丁烷 | B. | 乙烷、丙烷 | C. | 只有乙烷 | D. | 戊烷和己烷 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
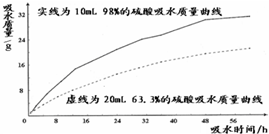
查看答案和解析>>
科目: 来源: 题型:解答题
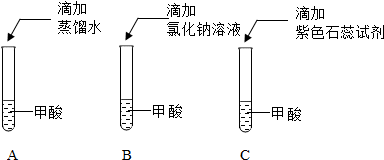
查看答案和解析>>
科目: 来源: 题型:实验探究题
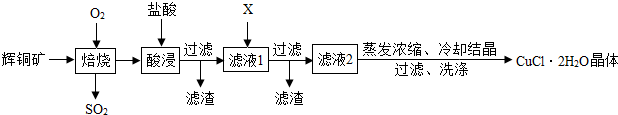
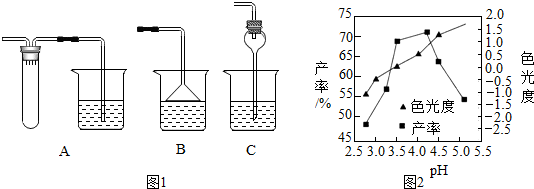
查看答案和解析>>
科目: 来源: 题型:实验探究题
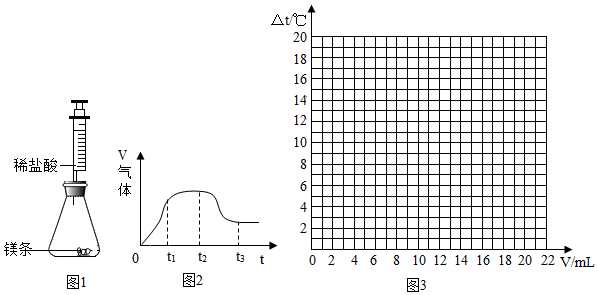
| 加入稀盐酸的体积(V)/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度的变化 (△t)/℃ | 0 | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
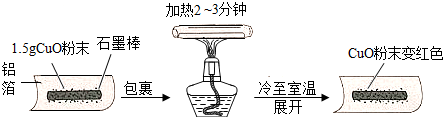
查看答案和解析>>
科目: 来源: 题型:实验探究题
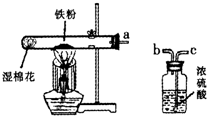 某校化学兴趣小组的同学在阅读资料时发现,18世纪末,法国科学家拉瓦锡曾经做了这样-个实验:让水蒸气通过一根烧红的枪管,生成了一种气体.同学们对这个实验很感兴趣:难道红热的铁能与水蒸气反应?生成的气体又是什么?带着这些疑问,他们设计了如图所示的装置进行探究.
某校化学兴趣小组的同学在阅读资料时发现,18世纪末,法国科学家拉瓦锡曾经做了这样-个实验:让水蒸气通过一根烧红的枪管,生成了一种气体.同学们对这个实验很感兴趣:难道红热的铁能与水蒸气反应?生成的气体又是什么?带着这些疑问,他们设计了如图所示的装置进行探究.| 操作方法 | 现象 | 结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com