
科目: 来源: 题型:实验探究题
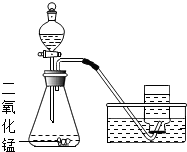 在氧气制取和检验实验中.
在氧气制取和检验实验中.| 集气瓶标号 | A | B | C | D | E |
| 氧气体积分数(%) | 80 | 70 | 65 | 60 | 55 |
| 铁丝燃烧状况 | 燃烧剧烈 | 燃烧较剧烈 | 燃烧不剧烈 | 燃烧较微弱 | 不燃烧,发红 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
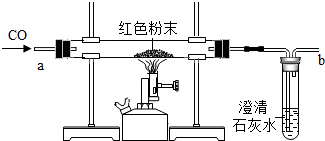 在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.
在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.| 实验中可能出现的现象 | 结论 |
| 假设1成立 | |
| 假设2成立 | |
| 假设3成立 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
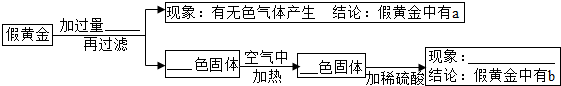
查看答案和解析>>
科目: 来源: 题型:实验探究题
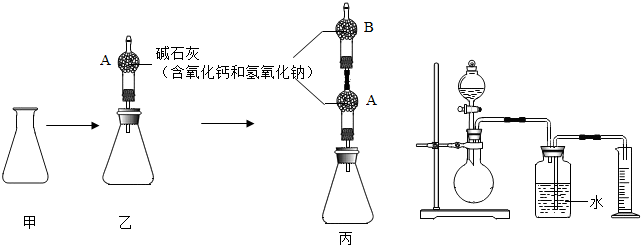
查看答案和解析>>
科目: 来源: 题型:实验探究题
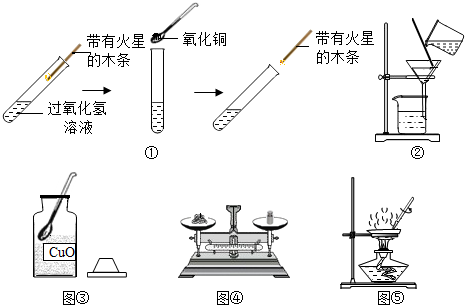
查看答案和解析>>
科目: 来源: 题型:实验探究题
 鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,取滤液适量于试管中,滴加澄清石灰水 | 溶液变浑浊 | 你的猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入少量稀盐酸 | 无明显现象 | 猜想成立 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
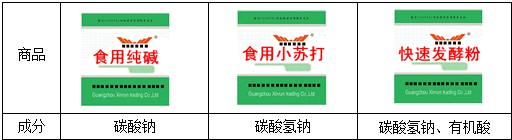
| 性质 | 碳酸钠 | 碳酸氢钠 |
| 溶解性 | 20℃时溶解度21.6g,溶解时放热 | 20℃时溶解度9.8g,溶解时放热 |
| 加热 | 不分解 | 发生分解反应,分解产物为碳酸钠、二氧化碳和水. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com