
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 | 没有气泡生成 | 猜想1正确 |
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体加入足量氯化钙溶液 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2.过滤、取少量滤液加入无色的酚酞试液 | 变成红色 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
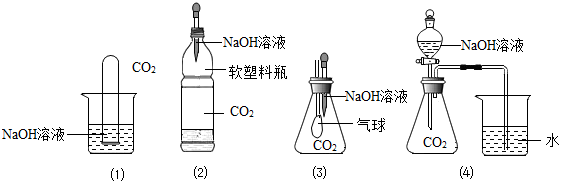
| 实验方法、现象 | 实验结论 |
| 验证了二氧化碳和氢氧化钠溶液反应 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 “双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体,某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示.同学们对这包久置的“504双吸剂”的固体样品很好奇,设计实验进行探究.
“双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体,某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示.同学们对这包久置的“504双吸剂”的固体样品很好奇,设计实验进行探究.| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体研碎,和磁铁吸引 | 有少量黑色固体被吸引 | 固体中一定有含有铁粉 |
| ②取①中残留固体加入足量水,充分溶解并过滤,向滤液中通入CO2 | 发现滤液变浑浊 | 滤液中含有氢氧化钙 |
| ③向②的滤渣中加入足量稀盐酸 | 产生气泡,得到无色溶液 | 固体中一定含有CaCO3;一定不含有Fe2O3 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验中可能出现的现象 | 结论 |
| ①黑色粉末没有溶解 | 假设1成立 |
| ② | 假设2成立 |
| ③ | 假设3成立 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| ①从样品中取一定量的固体于试管中,加入足量稀盐酸 ②从样品中取一定量的固体于试管中,加入一定量的水,滴加无色酚酞试液 | 产生气泡; 酚酞试液变红色 | 猜想Ⅲ成立 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
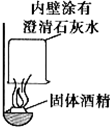 某校化学兴趣小组的同学在一次聚餐中,发现并对燃料固体酒精产生了好奇,于是对其成分进行了探究.
某校化学兴趣小组的同学在一次聚餐中,发现并对燃料固体酒精产生了好奇,于是对其成分进行了探究.查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 | |
| 乙同学 实验 | 取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液中 | 铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色 | 猜想(2)成立 |
| 丙同学 实验 | 取中和反应后的溶液少许于试管中,向试管中滴加几滴无色酚酞试液 | 溶液变红色 | 猜想(3)成立 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
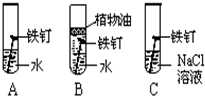

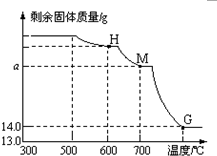
查看答案和解析>>
科目: 来源: 题型:解答题
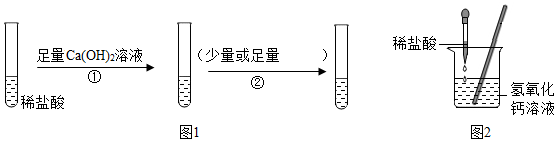
| 实验步骤 | 实验现象 | 解释和结论 |
| 取少量烧杯内溶液于试管中,滴入几滴酚酞试液(填试剂名称) | 溶液不变红 | 猜想一不正确 |
| 取少量烧杯内溶液于另一支试管中,滴加碳酸钠溶液至过量 | 开始有气泡产生,一段时间后产生沉淀 | 猜想二不正确 猜想三正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com