
科目: 来源: 题型:解答题
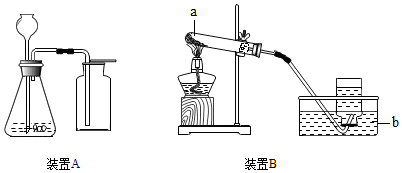 如图是实验室制取气体常用的两套装置.
如图是实验室制取气体常用的两套装置.查看答案和解析>>
科目: 来源: 题型:实验探究题
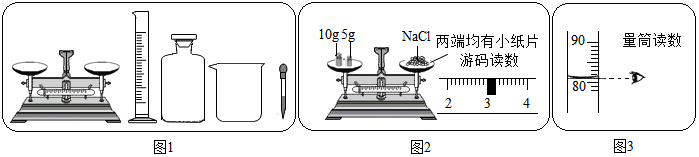
查看答案和解析>>
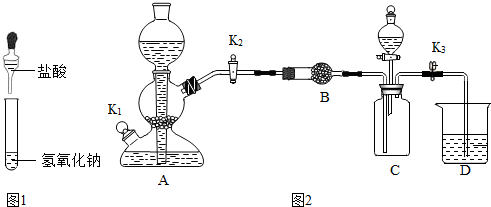
科目: 来源: 题型:实验探究题
| 步骤 | 现象 | 结论 |
| 取少量溶液a,滴加氯化铜溶液 | 溶液中无蓝色絮状沉淀 | 不含氢氧化钠 |
| 方案 | 步骤 | 现象 |
| 一 | 取少量溶液a,滴加硝酸银溶液 | 产生白色沉淀 |
| 二 | 取少量溶液a,加入镁粉 | 产生气泡 |
| 液体 | 步骤 | 现象 |
| 水 | 打开分液漏斗活塞,加入液体后关闭活塞 | D中导管先有气泡冒出,后D中石蕊试液倒流较少或D中导管倒吸一段水柱 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
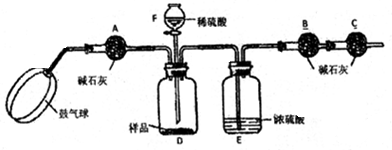
查看答案和解析>>
科目: 来源: 题型:解答题
 某同学取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,如图:
某同学取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,如图:查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
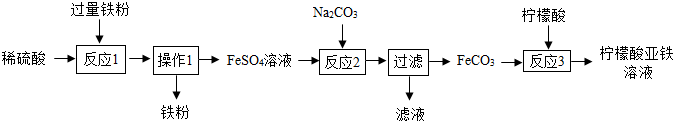
查看答案和解析>>
科目: 来源: 题型:填空题
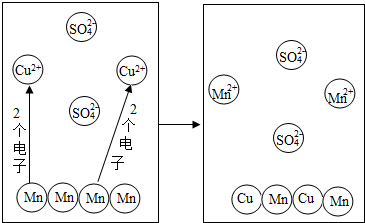 从微观的角度了解物质及其变化,有助于更好的认识物质组成和变化的本质.
从微观的角度了解物质及其变化,有助于更好的认识物质组成和变化的本质.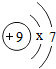 ,则x=2,在化学反应中氟原子易得到(填“得到”或“失去“)电子.
,则x=2,在化学反应中氟原子易得到(填“得到”或“失去“)电子.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2的质量为44g | B. | 气体Y的质量为28g | ||
| C. | 气体Y可能为甲烷 | D. | 方程式中b和c的比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com