17.某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验.

(1)写出仪器a的名称锥形瓶.
(2)甲同学从上图中选择B、E装置的组合制取氧气,反应的化学方程式为2H
2O
2$\frac{\underline{\;MnO_2\;}}{\;}$2H
2O+O
2↑.在用橡皮管连接装置B和E中的玻璃导管时,应先把玻璃管口用水润湿,然后稍稍用力把玻璃管插入橡皮管.收集气体前,应将集气瓶装满水并盖上玻璃片.收集氧气还可选用的装置是C.
(3)乙同学称取一定质量的KMnO
4固体放入大试管中,将温度控制在250℃加热制取O
2,实验结束时,乙同学发现用排水法收集到的O
2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想Ⅰ:反应生成的MnO
2分解放出O
2;
猜想Ⅱ:反应生成的K
2MnO
4分解放出O
2;
猜想Ⅲ:反应生成的K
2MnO
4和MnO
2分解都放出O
2.
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO
2,在250℃条件下加热一段时间,冷却后测得MnO
2的质量不变,则猜想Ⅰ错误;第二组同学取K
2MnO
4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该同学选择的实验方法是将加热K
2MnO
4产生的气体收集并用带火星的木条进行检验.
【拓展延伸】实验发现,KClO
3固体加热制取O
2的反应速率很慢,但如果将KMnO
4固体与KClO
3固体混合加热,则KClO
3分解速率加快.请说明KMnO
4在KClO
3分解反应中是否作催化剂,为什么?不是,因为KMnO
4的质量和化学性质在反应前后发生改变(或因为高锰酸钾在受热时发生分解).
【实验反思】通过以上实验探究,你对“实验室制取氧气”还想探究的问题是氯酸钾分解的最佳温度是什么?.

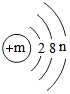 (其中n≠0),若m-n=10,则该粒子对应的常见金属元素有
(其中n≠0),若m-n=10,则该粒子对应的常见金属元素有
 A~H是初中化学常见的物质,已知A为黑色固体单质,G为紫红色固体单质,B为红棕色粉末,H为蓝色的硫酸盐溶液.它们的转化关系如图所示,回答下列问题.
A~H是初中化学常见的物质,已知A为黑色固体单质,G为紫红色固体单质,B为红棕色粉末,H为蓝色的硫酸盐溶液.它们的转化关系如图所示,回答下列问题.