
科目: 来源: 题型:实验探究题
| 检验气体的实验 | |
| 检验固体的实验 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
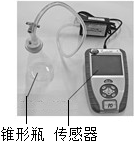 小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.
小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.| 时间/s 试剂 压强/KPa | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL 5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入氯化铁溶液 | 102.21 | 105.35 | 115.40 | 129.69 | 145.52 | 163.99 |
| 加入氯化铜溶液 | 101.50 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
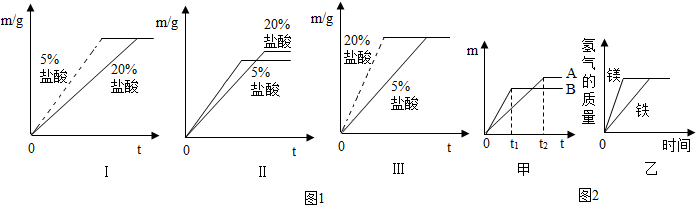
查看答案和解析>>
科目: 来源: 题型:实验探究题
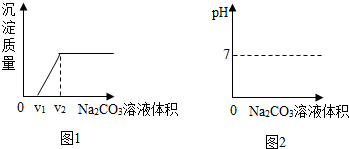
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验操作 | 实验结果 |
| (1)取少量试剂瓶内溶液于试管中,并加入过量酚酞试液. | 溶液呈红色 |
| (2)再向上述溶液中加入适量BaCl2溶液. | 有白色沉淀生成 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
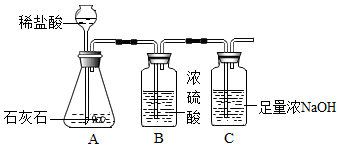
| 时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 大理石碎屑生成的CO2质量/克 | 0 | 1.45 | 1.75 | 1.98 | 2.18 | 2.30 | 2.36 | 2.40 | 2.40 | 2.40 |
| 块状大理石生成的CO2质量/克 | 0 | 0.45 | 0.80 | 1.10 | 1.36 | 1.60 | 1.81 | 1.98 | 2.11 | 2.20 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量白酒于试管中,滴入几滴橙色的K2Cr2O7酸性溶液 | 溶液变成蓝绿色 | 猜想1成立 |
| ②取少量白酒于试管中,滴入几滴紫色石蕊试液 | 石蕊试液不变色 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体剩余物于试管中, 向其中加入足量的稀盐酸. | 固体部分溶解,溶液为无色. | 假设①成立. |
| 固体部分溶解,溶液为蓝色. | 假设②成立. | |
| 固体部分溶解,有气泡产生,溶液为无色. | 假设③成立. |
| 实验组别 | I | II | III | IV | V |
| 药 品 | Al | Fe | Ag | Al | Cu |
| CuO | CuO | CuO | Fe2O3 | Fe2O3 | |
| 相同条件下是否反应 | 是 | 是 | 否 | 是 | 否 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 解释与结论 |
| 取澄清溶液A逐滴滴入一定量氢氧化钠溶液 | 开始无明显现象,后产生白色沉淀 | 原因是NaOH+HCl═NaCl+H2O,AlCl3+3NaOH=Al(OH)3↓+3NaCl. (用化学方程式表示) |
| 继续滴入氢氧化钠溶液直至过量 | 白色沉淀溶解 | 摩擦剂中还含有氢氧化铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com