
科目: 来源: 题型:实验探究题
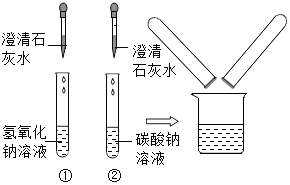 鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己的猜想不成立 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
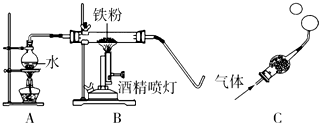
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
| 能否与盐酸反应 | 能 | 能 | 能 |
| 实验操作 | 实验现象及结论 |
| ④取少量黑色固体于试管中,加入足量的稀盐酸 | ⑤若固体全部溶解,没有气泡冒出,则猜想二正确;若固体全部溶解,有气泡冒出,则猜想一正确 |
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
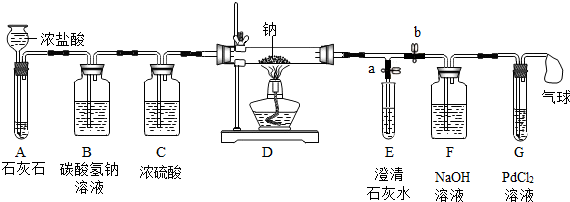
| 序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| ① | 打开a,关闭b,由长颈漏斗注入浓盐酸 | A中产生大量气泡 E中出现浑浊 | E中反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体 G中产生黑色沉淀 | 反应产物一定有C和CO |
| ③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 判 断 | 依 据 |
| 不是KMnO4 | KMnO4能溶于水形成紫红色溶液 |
| 不是K2MnO4(填化学式) | 冲洗试管时出现深绿色溶液,说明该物质能溶于水 |
| 是MnO2 | 其他实验用过MnO2,知道它是不溶于水的黑色固体 |
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:填空题
| 序号 | ① | ② | ③ | ④ |
| 物质 | 醋酸 | 水 | 熟石灰 | 纯碱 |
| 化学式 | CH3COOH | H2O | Ca(OH)2 | Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.
食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.| 实验操作 | 实验现象 | 实验结论 |
| 甲:取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时触摸试管外壁,感觉发烫,试管底部有不溶物,溶液变红色. | 甲:固体中一定含有CaO和Ca(OH)2 |
| 乙:另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 乙:固体中一定含有铁,一定不含有Fe2O3 |
| 丙:将乙产生的气体通入到澄清石灰水中 | 澄清石灰水中变浑浊 | 丙:固体中一定含有CaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com