
科目: 来源: 题型:选择题
| A. | 用过量的O2除去CO2中的CO | B. | 用过量的HC1溶液除去Cu中CuO | ||
| C. | 用过量的NaOH除去CaCl2溶液中HCl | D. | 用过量的FeSO4,除去Zn中Fe |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一个达菲分子中含有一个N2分子 | |
| B. | 达菲分子中C、N、0、P的原子个数比是8:1:4:1 | |
| C. | 达菲由五种元素组成 | |
| D. | 达菲相对分子质量为410g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化硫的产生主要原因是煤的大量燃烧 | |
| B. | 海底埋藏着大量的可燃冰,它不可能成为未来的新能源 | |
| C. | 氢气极易燃烧,燃烧的产物是水,被认为是最淸洁的燃料 | |
| D. | 化石燃料面临被耗尽的危险,人类正在利用和开发新的能源.如太阳能、风能、地热能等 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
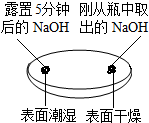 | 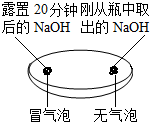 | 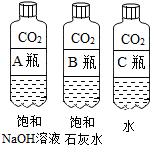 |
| 实验一 | 实验二 | 分析 |
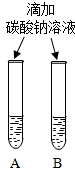 | 微热(不考虑水分蒸发)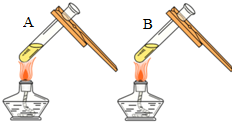 | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大. |

查看答案和解析>>
科目: 来源: 题型:填空题
 ”和“
”和“ ”分别表示氧原子和汞原子,如图是氧化汞在加热条件下发生分解反应的微观模拟图.请回答下列问题:
”分别表示氧原子和汞原子,如图是氧化汞在加热条件下发生分解反应的微观模拟图.请回答下列问题: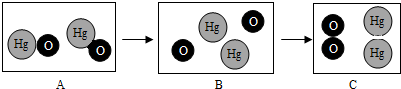
查看答案和解析>>
科目: 来源: 题型:实验探究题
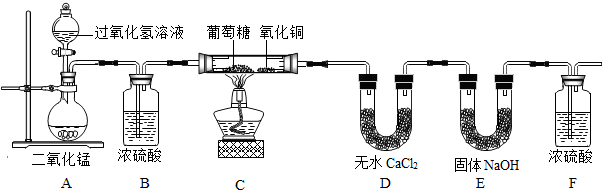
| 实验事实 | 数据分析及结论 |
| 1.8g葡萄糖完全燃烧,得到2.64g CO2和1.08g H2O | 根据数据分析可得出结论: 葡萄糖中含有C、H、O元素. |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 实验①:取少量滤液于试管中,加入适量的纯碱溶液,振荡. | 无明显现象 | 猜想Ⅱ不成立 |
| 实验②取少量滤液于试管中,加入适量的氢氧化钡溶液,振荡 | 产生白色沉淀 | 猜想Ⅲ成立 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com