
科目: 来源: 题型:实验探究题
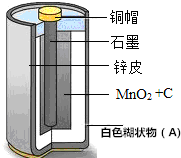 小意对自己使用的一节废旧干电池进行了系列探究;
小意对自己使用的一节废旧干电池进行了系列探究;查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |  |  | 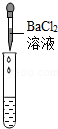 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡 产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
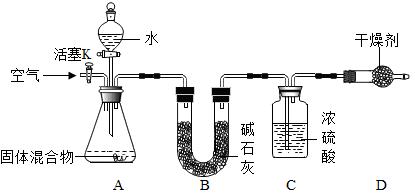
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| ?取上述试管中的上层清液,滴加1─2滴无色酚酞试液 | 溶液呈红色 | 白色粉末中含有Ca(OH)2 |
| ?往上述试管残留的白色固体中滴加稀盐酸 | 有气泡产生 | 白色粉末中含CaCO3 |
查看答案和解析>>
科目: 来源: 题型:实验探究题

| 实验步骤 | 实验现象 | 实验结论 |
| ①取无色滤液少许于试管中,滴加BaCl2溶液 | 产生白色沉淀 | 猜想Ⅱ不成立 |
| ②在①反应后的试管中滴加无色酚酞溶液 | 溶液变为红色 | 猜想Ⅲ成立 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 现象 | 结论 |
| 情况①正确 |
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量剩余固体于试管中,加水振荡,过滤,取滤液滴加无色酚酞溶液 | 溶液变红 | 猜想Ⅲ成立 |
| ②取滤渣滴加足量的稀盐酸 | 有气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com