
科目: 来源: 题型:实验探究题
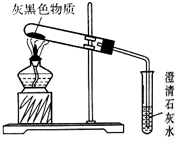 镁是一种银白色的金属,但实验室看到的镁条常常有一层灰黑色的“外衣”,这层灰黑色的外衣是什么物质呢?甲同学认为是MgO;乙同学认为是Mg2(OH)2CO3;丙同学认为是Mg(OH)2.
镁是一种银白色的金属,但实验室看到的镁条常常有一层灰黑色的“外衣”,这层灰黑色的外衣是什么物质呢?甲同学认为是MgO;乙同学认为是Mg2(OH)2CO3;丙同学认为是Mg(OH)2.查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
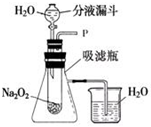 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.查看答案和解析>>
科目: 来源: 题型:实验探究题
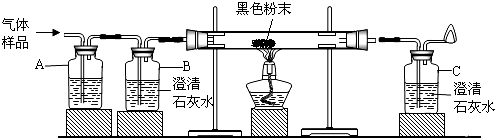
 某化学兴趣小组的同学将一枚洁净的铁钉放入食盐水中(如图所示,装置气密性良好).一段时间后,进行观察.请你一起参与分析,并完成后续实验设计.
某化学兴趣小组的同学将一枚洁净的铁钉放入食盐水中(如图所示,装置气密性良好).一段时间后,进行观察.请你一起参与分析,并完成后续实验设计.| 实验步骤 | 实验现象 | 实验结论 |
| 你选用的试剂是: |
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 解释或结论 |
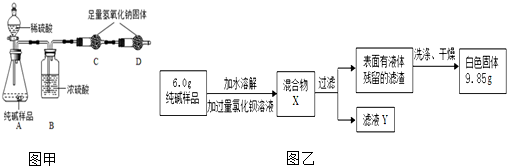
| ①取适量的烧碱样品置于试管中加水溶解,用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠溶于水时放出热量 |
| ②向①所得的溶液中加入盐酸至过量. | 开始时无明显现象,过一段时间后有气泡产生. | 说明样品中含有杂质Na2CO3 |
| ③向②所得的溶液中加入硝酸银溶液. | 有白色沉淀产生. | AgNO3+NaCl═AgCl↓+NaNO3 说明样品中含有杂质氯化钠 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
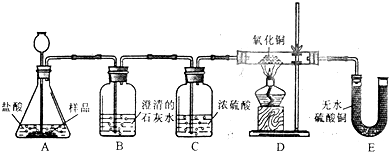
查看答案和解析>>
科目: 来源: 题型:实验探究题
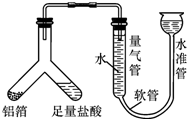 梧州市某中学化学兴趣小组的同学到超市购买锡纸用于烧烤,同学们看见商品标签上表明锡纸的材质为“铝箔”.
梧州市某中学化学兴趣小组的同学到超市购买锡纸用于烧烤,同学们看见商品标签上表明锡纸的材质为“铝箔”.| 实验一:4mL8%CuSO4溶液 | 实验二:4mL8%CuCl2溶液 | |
| 实验 现象 | 短时间内无变化,一段时间后铝片上才出现少量红色的铜 | 铝片上迅速有红色的铜出现 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
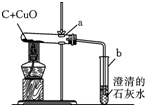 有一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分,取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察.如表是实验中可能出现的现象与对应结论,请你填写表中空白处的相关内容:
有一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分,取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察.如表是实验中可能出现的现象与对应结论,请你填写表中空白处的相关内容:| 现象 | 结论 |
| 溶液呈蓝色,有黑色不溶物 | 含CuO、C |
| 溶液颜色无明显变化,有黑色不溶物 | 只含C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com