
科目: 来源: 题型:多选题
| A. | “超纯水”、“超纯蒸馏水”绝对卫生,对人体有益 | |
| B. | 本饮料由纯天然物质配制而成,绝对不含化学物质,对人体无害 | |
| C. | 含氟牙膏可以预防龋齿 | |
| D. | 铅笔不是铅、水银不是银、纯碱不是碱 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
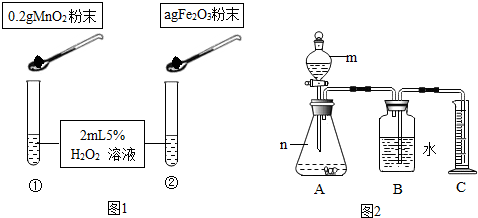
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用50 mL量筒量取5.26 mL水 | |
| B. | 用托盘天平称取5.6 g 铁粉 | |
| C. | 用pH试纸测得苹果汁的pH为3.2 | |
| D. | 用温度计测得某NaOH溶液的温度为20.35℃2 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
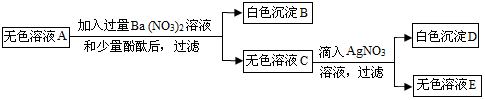
查看答案和解析>>
科目: 来源: 题型:实验探究题
 如图,为测空气中氧气的含量,用一个50ML量筒倒扣在水中,量筒内外液面均位于40ML处.量筒内浮着一个铜制的小船,船中放有少量白磷.现把氢氧化钠缓缓投入水中并搅拌,这样做的原因是NaOH固体溶解于水时放出热量,使溶液温度升高,达到白磷的着火点,放白磷的小船用铜做的原因是铜导热性好且化学性质稳定.一会儿,白磷发生自燃,还可以观察到产生大量白烟,量筒中的液面先下降再上升,最终,液面大约位于量筒刻度32mL处.
如图,为测空气中氧气的含量,用一个50ML量筒倒扣在水中,量筒内外液面均位于40ML处.量筒内浮着一个铜制的小船,船中放有少量白磷.现把氢氧化钠缓缓投入水中并搅拌,这样做的原因是NaOH固体溶解于水时放出热量,使溶液温度升高,达到白磷的着火点,放白磷的小船用铜做的原因是铜导热性好且化学性质稳定.一会儿,白磷发生自燃,还可以观察到产生大量白烟,量筒中的液面先下降再上升,最终,液面大约位于量筒刻度32mL处.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验探究题
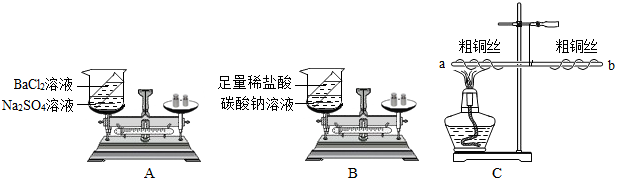
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com