
科目: 来源: 题型:多选题
| A. | 蒸发滤液时,待蒸发皿中出现较多固体后可进行间歇加热,尽量将水分蒸干 | |
| B. | 配制氯化钠溶液需要经过计算、称量、量取、溶解、装液、贴标签等步骤 | |
| C. | 粗盐溶解和进行过滤操作时,都用到玻璃棒,但玻璃棒的作用不同 | |
| D. | 配制溶液时必备的仪器有托盘天平、滴管、药匙、酒精灯、量筒、烧杯、玻璃棒等 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
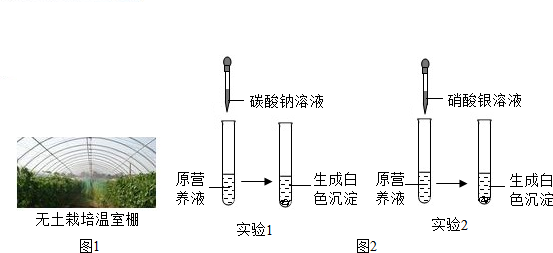
查看答案和解析>>
科目: 来源: 题型:实验探究题
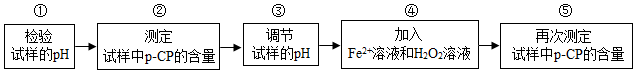
| 实验编号 | 温度/℃ | pH | 测得p-CP的含量随时间变化的关系图 |
| a | 25 | 10 | 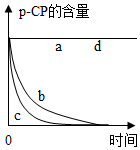 |
| b | 25 | 3 | |
| c | 40 | 3 | |
| d | 40 | 10 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
 某同学进行了如下的探究实验.
某同学进行了如下的探究实验.| 实验内容 | 现象 | 难溶固体的成分 |
| 取难溶固体于试管中,加入过量稀盐酸 | 固体部分溶解,溶液变黄 | Ⅰ.一定有铜 Ⅱ.一定有铁 Ⅲ.一定有氧化铁 Ⅳ.至少有三种物质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中子数为6 | B. | 质子数为6 | ||
| C. | 电子数为6 | D. | 质子数和中子数之和为14 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 化学兴趣小组对实验室药品柜中的一瓶盐酸的性质和质量分数进行探究,请你参与:
化学兴趣小组对实验室药品柜中的一瓶盐酸的性质和质量分数进行探究,请你参与:| 实验步骤 | 预计实验现象 |
| 取少量溶液于试管中,滴加石蕊试液 | 溶液变红色 |
| 另取少量溶液于试管中,把镁条伸入溶液中 | 产生气泡 |

查看答案和解析>>
科目: 来源: 题型:实验探究题
 同学们正在化学实验室完成“实验活动6--酸、碱的化学性质”
同学们正在化学实验室完成“实验活动6--酸、碱的化学性质”查看答案和解析>>
科目: 来源: 题型:解答题
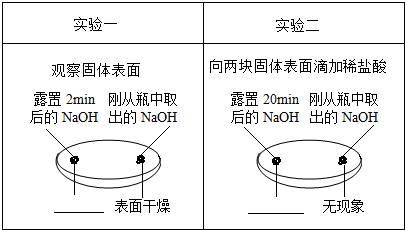
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com