
科目: 来源: 题型:实验探究题
| 实验方法 | 实验现象 | 结论 |
查看答案和解析>>
科目: 来源: 题型:填空题
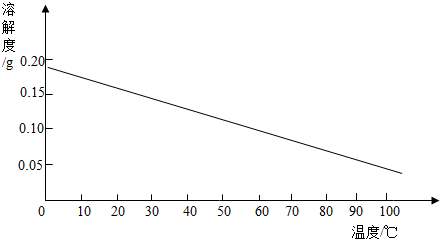
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验探究题
 某化学活动小组在一次实验中进行了如图所示实验:此时观察到的实验现象是(1)U形玻璃管左、右两端均产生白色沉淀.
某化学活动小组在一次实验中进行了如图所示实验:此时观察到的实验现象是(1)U形玻璃管左、右两端均产生白色沉淀.查看答案和解析>>
科目: 来源: 题型:解答题
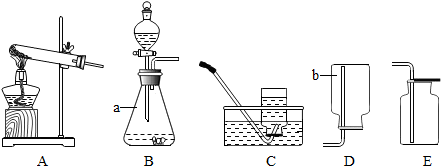
查看答案和解析>>
科目: 来源: 题型:填空题
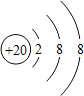 ;
;查看答案和解析>>
科目: 来源: 题型:实验探究题

| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品放入试管中,滴加一定量的稀盐酸.用带异管的单孔橡皮塞塞紧试管口,导管另一端伸入澄清石灰水中. | 试管中固体逐漸减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊. | 样品中一定含有Fe和CaCO3, 不含Fe2O3. |
| ②取少量样品放入试管中,加水溶解,静置后取上层清液滴加无色酚酞试液. | 试管底部有不溶物,上层清液由无色变为红色. | 样品中含有氧化钙或氢氧化钙或二者都有 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验一 | 实验二 |
 | 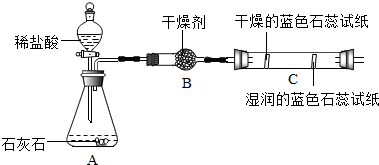 |
| 实验三 | 实验四 |
 |  |
| 实验五 | |
 |  |
| 硬质玻璃管的容积 | 反应前注射器中气体体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL |
查看答案和解析>>
科目: 来源: 题型:填空题
| 组别 | 化学方程式 | 结论 |
| Ⅰ | 6CO2+6H2O$\frac{\underline{\;\;\;光照\;\;\;}}{叶绿素}$C6H12O6+6O2 CO2+H2O═H2CO3 | 反应物相同,生成物不同, 原因反应条件不同. |
| Ⅱ | Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | 反应物相同,生成物不同, 原因反应物的浓度不同. |
| Ⅲ | C+O2(充足)$\frac{\underline{\;点燃\;}}{\;}$CO2 2C+O2(不充足)$\frac{\underline{\;点燃\;}}{\;}$2CO | 反应物相同,生成物不同, 原因反应物的量不同. |
| Ⅳ | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑(反应缓慢) 2KClO3$\frac{\underline{\;MnO_{2}\;}}{加热}$2KCl+3O2↑(反应迅速) | 反应物相同,反应速率不同, 原因有无催化剂. |
| 实践与应用 | 科学探究正努力实现对化学反应的控制,很多化学家致力于研究二氧化碳的“组合转化”技术,把过多二氧化碳转化为有益于人类的物质.若让二氧化碳和氢气在一定条件下反应,可生成一种重要的化工原料,反应的化学方程式如下: 2CO2+6H2$\frac{\underline{\;催化剂\;}}{△}$X+4H2O,推断X的化学式是C2H4. | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com