
科目: 来源: 题型:选择题
| A. | 空气是一种宝贵的资源,其中含量最多的物质是氮气 | |
| B. | 生物细胞中含量最多的元素是钙元素 | |
| C. | 地壳中含量最多的金属元素是硅元素 | |
| D. | 地球上的淡水很少,可利用的淡水更少,可利用的淡水约占全球储水量的2.53% |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验编号 | 选用金属(质量形状相同) | 盐酸浓度(相同体积) | 产生氢气的体积/mL | |||||
| 0 | t1 | t2 | t3 | t4 | t5 | |||
| Ⅰ | 锌片 | 6% | 0 | 1 | 2 | 3 | 3 | 3 |
| Ⅱ | 锌片 | 3% | 0 | 0.6 | 1.2 | 1.8 | 2.4 | 3 |

查看答案和解析>>
科目: 来源: 题型:实验探究题
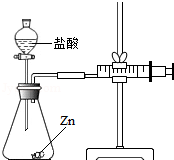 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 化学兴趣小组以“酸碱盐的性质”为主题进行探究性学习,请你作为该小组成员一起来解决下列问题:
化学兴趣小组以“酸碱盐的性质”为主题进行探究性学习,请你作为该小组成员一起来解决下列问题:查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
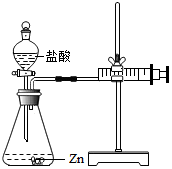 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 步骤Ⅰ:将反应后试管中的固体加水充分溶解、过滤、将干燥后滤渣加入足量稀硫酸溶液中. | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤Ⅱ:在图1的试管和集气瓶之间连图所示的装置,重新进行加热硝酸铜的实验.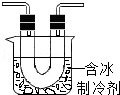 | 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |

查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com