
科目: 来源: 题型:计算题
| 反应前 | 反应后 | ||
| 实验数据 | 烧杯和过氧化氢溶液的质量/g | 硫酸铜溶液的质量/g | 烧杯和烧杯中溶液的质量/g |
| 50 | 3.3 | 52.5 | |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
 水是生命之源,“爱惜水,保护水”是每个公民的义务和责任.
水是生命之源,“爱惜水,保护水”是每个公民的义务和责任.查看答案和解析>>
科目: 来源: 题型:计算题
 鸡蛋壳的主要成分是碳酸钙(其他成分不与水也不与盐酸反应).为了测定鸡蛋壳碳酸钙的含量,进行如下实验:请回答下列问题:(两者恰好完全反应)
鸡蛋壳的主要成分是碳酸钙(其他成分不与水也不与盐酸反应).为了测定鸡蛋壳碳酸钙的含量,进行如下实验:请回答下列问题:(两者恰好完全反应)查看答案和解析>>
科目: 来源: 题型:多选题
| 物质 | A | B | C | D |
| 反应前(g) | 17 | 16 | 15 | 0 |
| 反应后(g) | 13 | X | 26 | Y |
| A. | 该项反应的A、B的质量比为1:1 | |
| B. | 该反应中X的值是16 | |
| C. | 该反应中Y的值是9 | |
| D. | 若A、B、C、D的相对分子质量分别为16、32、44、18,则该反应的化学方程式可表示为A+B=C+D |
查看答案和解析>>
科目: 来源: 题型:解答题
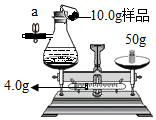 某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量.他们准确称量两份质量各为10.0g的铁粉样品,分别进行如下操作:
某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量.他们准确称量两份质量各为10.0g的铁粉样品,分别进行如下操作:查看答案和解析>>
科目: 来源: 题型:实验探究题
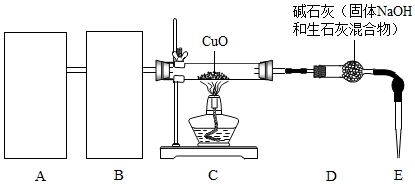
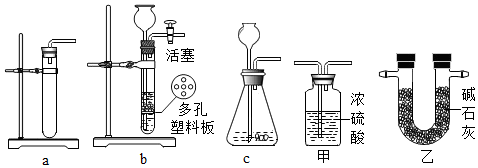
查看答案和解析>>
科目: 来源: 题型:计算题
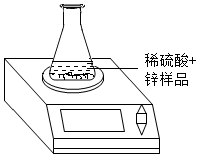 为测定某金属锌样品中锌单质的质量分数,称取该样品进行如图所示实验.多次实验后,所得数据(平均值)如下表:
为测定某金属锌样品中锌单质的质量分数,称取该样品进行如图所示实验.多次实验后,所得数据(平均值)如下表:| 反应前质量 | 充分反应后质量 | |
| 装置+稀硫酸(足量) | 锌样品 | 装置+剩余物质 |
| 342.10g | 16.00g | 357.70g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com