
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量反应后的溶液于试管中,滴加酚酞溶液. | 溶液不变红色. | 猜想Ⅲ不正确. |
| ②再另取少量反应后的溶液于另一支试管中,向里面加入适量碳酸钙. | 有气泡产生. | 猜想Ⅰ不正确. 猜想Ⅱ正确. |
查看答案和解析>>
科目: 来源: 题型:实验探究题
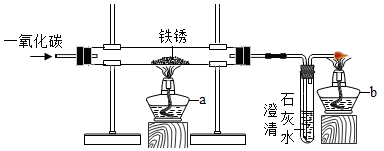
 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
查看答案和解析>>
科目: 来源: 题型:实验探究题

| 方法 | 实验步骤 | 实验现象 | 结论 |
| 1 | 盐酸过量 | ||
| 2 | 盐酸过量 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
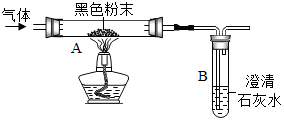 类比法是化学研究物质的重要方法.草酸(化学式为C2H2O4)的化学性质与盐酸相似.在受热条件下也会分解,仅生成三种氧化物.某校研究性学习小组对此展开探究:
类比法是化学研究物质的重要方法.草酸(化学式为C2H2O4)的化学性质与盐酸相似.在受热条件下也会分解,仅生成三种氧化物.某校研究性学习小组对此展开探究:查看答案和解析>>
科目: 来源: 题型:实验探究题
 央视频道《是真的吗?》栏目中有一段视频:将“锡纸”剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,观察到“锡纸”立即燃烧.据此,某同学取“锡纸”进行了以下探究:
央视频道《是真的吗?》栏目中有一段视频:将“锡纸”剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,观察到“锡纸”立即燃烧.据此,某同学取“锡纸”进行了以下探究:| 实验操作 | 实验现象 | 实验分析与结论 |
| 取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序 可知猜想Ⅱ(填“Ⅰ”或“Ⅱ”) 成立;反应的化学方程式为2Al+3ZnCl2=3Zn+2AlCl3. |
| 实验操作 | 实验现象 | 实验结论 |
 | 铁片表面有红色固体析出,银片表面无明显变化 | 铁、铜、银三种金属的活动性顺序是: Fe>Cu>Ag |
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放于试管中,滴加足量的稀盐酸. | 固体逐渐消失,有无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe, 一定不含Fe2O3. |
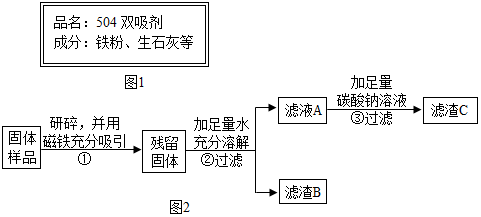
| 实验操作 | 实验现象 | 实验结论 |
| ①取滤渣B于试管中,加入适量稀盐酸 ②生成的气体通入澄清石灰水 | ①固体减少,有气泡冒出,溶液变为黄色 ②该溶液变浑浊. | 固体中一定含有CaCO3 和Fe2O3. |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可以闻到远处飘来的桂花香味 | |
| B. | 将糖块放入水中一段时间后糖块“消失”了 | |
| C. | 湿衣服在太阳下比在室内干得快 | |
| D. | 1L大米和1L芝麻混合,总体积小于2L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com