
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验探究题
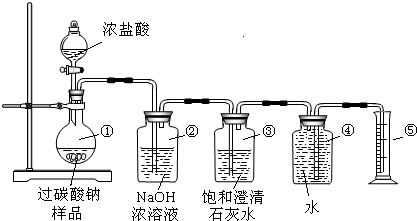
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10g 4%的氯化钠溶液 | B. | 20g 3%的氯化钠溶液 | ||
| C. | 30g 2%的氯化钠溶液 | D. | 40g 1%的氯化钠溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100% | B. | 80% | C. | 50% | D. | 30% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制取更多的氧气 | B. | 使氯酸钾又快又多地生成氧气 | ||
| C. | 防止装置爆炸 | D. | 使氯酸钾低温下快速分解 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 某小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:
某小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  向等质量且过量的锌和铁分别加入等质量且质量分数相同的稀盐酸 | |
| B. |  向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸 | |
| C. |  向一定量接近饱和的硝酸钠溶液中不断加入硝酸钠晶体(不考虑温度变化) | |
| D. | 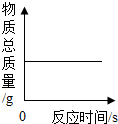 木炭在密闭的空气中燃烧,容器内的物质总质量随氧气变化情形 |
查看答案和解析>>
科目: 来源: 题型:填空题
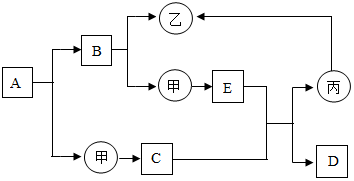 如图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质;A、B、C、D、E为化合物,且A与B的组成元素相同,D与C的组成元素也相同.已知E、丙均为黑色粉末,C和E在高温条件下可生成丙和D,B是最常见的一种溶剂,D能使澄清的石灰水变浑浊,其余反应条件、部分反应物和生成物均已略去.试推断回答:
如图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质;A、B、C、D、E为化合物,且A与B的组成元素相同,D与C的组成元素也相同.已知E、丙均为黑色粉末,C和E在高温条件下可生成丙和D,B是最常见的一种溶剂,D能使澄清的石灰水变浑浊,其余反应条件、部分反应物和生成物均已略去.试推断回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com