
科目: 来源: 题型:选择题
| A. | 硫--淡蓝色火焰--氧化反应 | |
| B. | 铁--火星四射--分解反应 | |
| C. | 碳--发出白光--化合反应 | |
| D. | 蜡烛--生成水和二氧化碳--化合反应 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染.同学们对废旧手机中的金属回收产生兴趣.
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染.同学们对废旧手机中的金属回收产生兴趣.| 种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
| 市场价格($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
| 矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
| 手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
| 序号 | 实验步骤 | 实验现象 |
| I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
| II | 将金属电路放入烧杯中,加入足量稀盐酸浸泡 | 溶液变成绿色,有无色气泡产生 |
| III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如右图所示装置中,进行实验.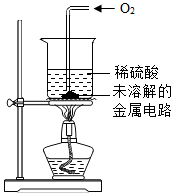 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
| IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
| V | 向IV中得到的滤液中加入铁片 | 得到红色固体 |
查看答案和解析>>
科目: 来源: 题型:选择题
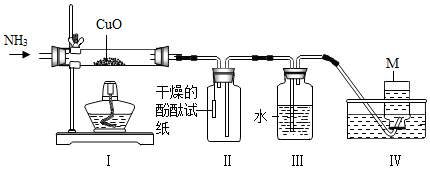
| A. | I中的固体逐渐变为红色 | B. | II中试纸会变成红色 | ||
| C. | 该实验无法证明有水生成 | D. | M可能是N2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2、HCl、CO | B. | N2、CO | ||
| C. | 一定有 N2、CO,可能有氯化氢 | D. | 一定有CO,可能有N2和HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定不存在Ba2+,可能存在NH4+ | B. | 一定存在CO32- | ||
| C. | 一定存在Na+ | D. | 一定不存在Cl- |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com