
科目: 来源: 题型:选择题
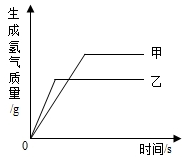 有甲、乙两种金属放入等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,则下列结论合理的是( )
有甲、乙两种金属放入等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,则下列结论合理的是( )| A. | 金属活动性甲>乙 | B. | 生成氢气的质量甲>乙 | ||
| C. | 参与反应的硫酸质量甲<乙 | D. | 参与反应的金属质量甲<乙 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 科学兴趣小组成员就一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁如图
科学兴趣小组成员就一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁如图查看答案和解析>>
科目: 来源: 题型:实验探究题
 化学兴趣小组对铁的性质做了如下探究:
化学兴趣小组对铁的性质做了如下探究:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用CO2气体就能区分NaOH、Ca(OH)2和稀盐酸三种溶液 | |
| B. | 若有BaCl2溶液,就有办法鉴别NaOH、Na2CO3、Na2SO4 | |
| C. | 有酚酞溶液,就能鉴别盐酸、Na2CO3和KNO3三种溶液 | |
| D. | 不用其它任何试剂就能将HCl、BaCl2、Na2CO3三种溶液鉴别出来 |
查看答案和解析>>
科目: 来源: 题型:解答题
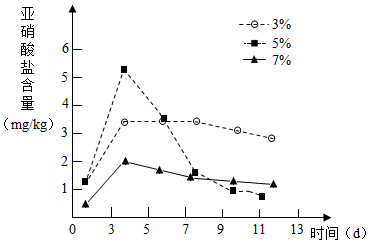 针对泡菜在发酵过程中会产生亚硝酸盐(致癌物质)的事实,某活动小组设计实验,探究不同食盐浓度和发酵时间对亚硝酸盐含量变化的影响,请回答:
针对泡菜在发酵过程中会产生亚硝酸盐(致癌物质)的事实,某活动小组设计实验,探究不同食盐浓度和发酵时间对亚硝酸盐含量变化的影响,请回答:查看答案和解析>>
科目: 来源: 题型:实验探究题
 甲同学认为Ca(OH)2与CO2反应,而NaOH与CO2不能反应,因为实验室里检验CO2用Ca(OH)2溶液而不用NaOH溶液.乙同学认为甲同学的说法不完全正确.请你帮助乙同学完成以下实验来证明他的观点.
甲同学认为Ca(OH)2与CO2反应,而NaOH与CO2不能反应,因为实验室里检验CO2用Ca(OH)2溶液而不用NaOH溶液.乙同学认为甲同学的说法不完全正确.请你帮助乙同学完成以下实验来证明他的观点.| 实验步骤 | 实验现象 | 结论 |
| 第一步:向集满CO2软塑料瓶中注入少量的NaOH溶液立即选好盖子,振荡 | 瓶子变瘪了 | NaOH溶液吸收了塑料瓶中的CO2气体. |
| 第二步:取上一步中所得溶液,加入盐酸 | 有大量气泡生成 | 化学方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:实验探究题
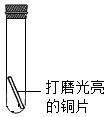 铜片在潮湿的空气中久置,表面会产生绿色的铜锈.某小组同学设计并进行实验,探究铜生锈的条件.
铜片在潮湿的空气中久置,表面会产生绿色的铜锈.某小组同学设计并进行实验,探究铜生锈的条件. | 编号 | 主要实验操作 | 实验现象 |
| 1 | 充满纯净的O2 | 铜片均无明显变化 |
| 2 | 充满纯净的CO2 | |
| 3 | 充满经煮沸并迅速冷却的蒸馏水 | |
| 4 | 加入蒸馏水5mL (液面未浸没铜片),再充满O2 | |
| 5 | 加入经煮沸并迅速泠却的蒸馏水5ml,再充满CO2 | |
| 6 | 充入10mLO2,再充入10mLCO2 | |
| 7 | 加入蒸馏水5mL,再依次充入l0mLCO2和10mLO2 | 铜片生锈,且水面附近锈蚀最严重 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
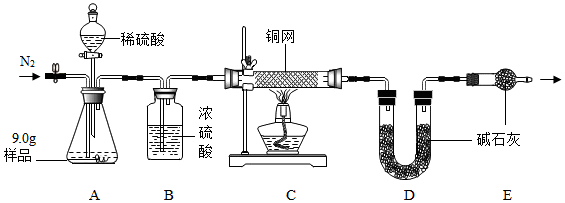
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 现象 | 结论及化学方程式 |
| ① ② | 因此三者的活动性:铁>铜>银 |
查看答案和解析>>
科目: 来源: 题型:解答题
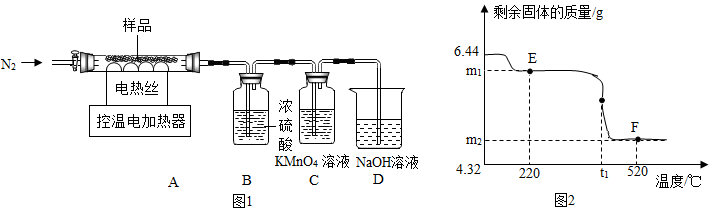
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com