
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:推断题
 已知A、B为两种黑色粉末,D为红色单质,A和D含有同一种元素.A、B、C、D、E五种物质之间的转化关系如图所示.请回答:
已知A、B为两种黑色粉末,D为红色单质,A和D含有同一种元素.A、B、C、D、E五种物质之间的转化关系如图所示.请回答:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 碳的耗用量称为“碳足迹”.一般情况下,排放的二氧化碳较多,碳足迹就越大.以下做饭可以减小“碳足迹”的是( )
碳的耗用量称为“碳足迹”.一般情况下,排放的二氧化碳较多,碳足迹就越大.以下做饭可以减小“碳足迹”的是( )| A. | 大量使用煤、石油等燃料 | B. | 减少一次性筷子的使用 | ||
| C. | 将生活垃圾进行焚烧处理 | D. | 以私家车出行代替公共交通工具 |
查看答案和解析>>
科目: 来源: 题型:计算题

查看答案和解析>>
科目: 来源: 题型:实验探究题
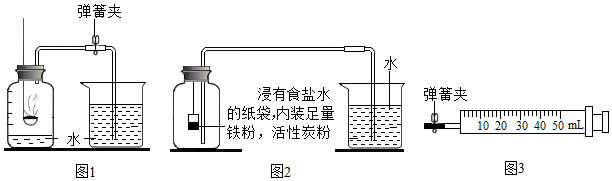
| 测量项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
| 体积/mL | 80.0 | 54.5 | 126.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com