
科目: 来源: 题型:实验探究题
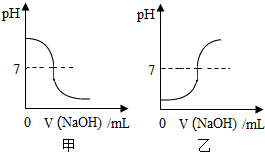 NaOH是化学实验中常用的试剂.
NaOH是化学实验中常用的试剂.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 序号 | 实验步骤 | 实验现象 | 实验结论与解释 |
| 1 | 取少量“污渍爆炸盐”于试管中,加入适量的水 | 固体溶解 | 该固体易溶于水且能与水反应 |
| 2 | 向1中所得的液体中加入适量的二氧化锰 | 产生大量气泡 | 试管中产生的气体是 O2(填化学式,下同),过碳酸钠和水反应生成的化合物乙是 H2O2 |
| 3 | 将带火星的小木条放在试管中,观察现象 | 木条复燃 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
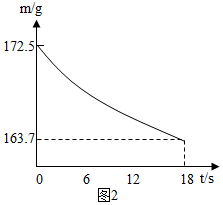
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可卡因由17个碳原子、21个氢原子、1个氮原子、4个氧原子构成 | |
| B. | 可卡因由C、H、O、N四中元素组成 | |
| C. | 一个可卡因分子含有43个原子 | |
| D. | 可卡因相对分子质量为303 |
查看答案和解析>>
科目: 来源: 题型:选择题
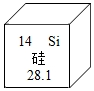 在元素中期表中,硅元素如图所示,下列关于硅的说法正确的是( )
在元素中期表中,硅元素如图所示,下列关于硅的说法正确的是( )| A. | 该原子的电子数是14 | B. | 该元素是地壳中含量最多的元素 | ||
| C. | 该元素排在元素周期表第二周期 | D. | 相对原子质量是28.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com