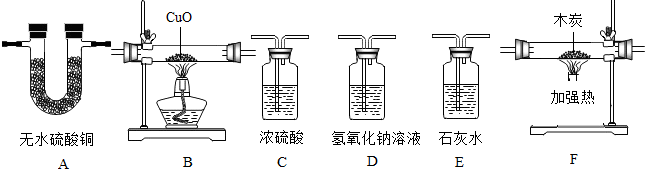
1.铁和铜是生活中常见的两种金属.让我们与甲、乙化学兴趣小组一起踏上探究之旅吧!
(一)兴趣小组甲:久置的铜制品表面能生成 Cu
2(OH)
2CO
3.甲组同学以锈蚀严重的废铜 屑为原料(假设不含其他杂质)制取纯铜.如图是兴趣小组设计的两种回收铜的实验方案:
查阅资料:Cu
2(OH)
2CO
3+2H
2SO
4═2CuSO
4+3H
2O+CO
2↑
【分析评价】(1)步骤Ⅱ中 CO 的作用是A(填字母).A.还原剂B.氧化剂
(2)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤.
(3)步骤Ⅴ过程发生反应的化学方程式为Fe+H
2SO
4═FeSO
4+H
2↑.
(4)同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一=(填“>”或“=”或“<”)方案二.以上两种方案中,方案二优越于方案一,理由是操作简单(答一点).
【拓展探究】在方案一中,小明和小丽分别取 24 克氧化铜,用 CO 还原,小明得到 19.2克红色固体,小丽得到 20.8 克红色固体.为什么两人得到的红色固体质量不相等?查阅资料:
Ⅰ.CO 还原 CuO 时也可产生红色的氧化亚铜(Cu
2O)Ⅱ.Cu
2O+H
2SO
4(稀)═Cu+CuSO
4+H
2O
他们分析推断:
(1)一致认为小明(填“小明”或“小丽”)的产物中没有 Cu
2O;
(2)用 CO 还原 8 克 CuO 得到红色固体 a 克,若红色固体为 Cu 和 Cu
2O 的混合物,则
a 的取值范围为6.4<a<7.2;
(3)可以用简单的实验验证红色固体中是否有 Cu
2O,请简述操作、现象及结论:取样滴加足量的稀硫酸,若溶液变蓝,说明含Cu
2O.
(二)兴趣小组乙:乙组同学对铁的锈蚀产生了浓厚的兴趣. 铁生锈是铁与空气中的一些物质反应生成氢氧化亚铁后,在空气中被氧化为氢氧化铁,氢氧化铁在日光照射下,缓慢分解,生成氧化铁 Fe
2O
3.铁锈的化学式可简单表示为 Fe
2O
3•nH
2O.
【提出问题】铁锈(Fe
2O
3•nH
2O)中 n 的值等于多少?
【查阅资料】(1)浓硫酸具有吸水性,是一种常用的液体干燥剂;碱石灰(是氢氧化钠 和氧化钙的混合物)可以吸收水和二氧化碳.
(2)Fe
2O
3•nH
2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe
2O
3+nH
2O
【问题探究】同学们发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了 探究铁锈(Fe
2O
3•nH
2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假 设不含其他杂质),按如图1所示装置进行实验.
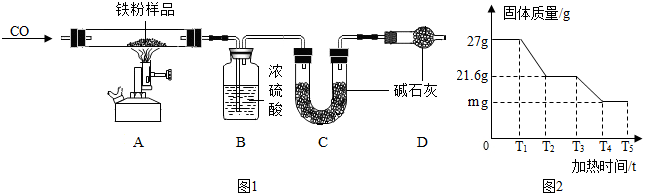
(1)实验开始前,连接好仪器并检查装置的气密性.
(2)实验中观察到 A 中的现象是固体逐渐变为黑色;请指出该装置中有一处明显不足未进行尾气处理.
【数据处理】以下是 B、C 中质量不再变化时 B 中浓硫酸、C 中碱石灰装置质量变化情况,以及 A 中固体质量和加热时间的关系图(T
5 后 A 中固体质量不再变化).
| | 反应前(g) | 反应后(g) |
| B | 100 | 105.4 |
| C | 150 | 163.2 |
(3)装置 C 的作用是吸收生成的二氧化碳.装置 B 和 C 是否可以颠倒?否(填“是”或“否”). 写出 T
3~T
4 时间段发生的化学方程式Fe
2O
3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO
2.
(4)n 的值为3.若没有装置 D,则 n 的值将偏小(填“偏大”或“偏小”或“无 影响”).
(5)关系图中 m 的值为16.8.

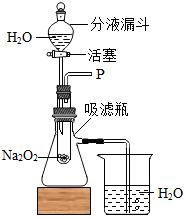 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小蔡很感兴趣,于是,他和同学们进行探究.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小蔡很感兴趣,于是,他和同学们进行探究.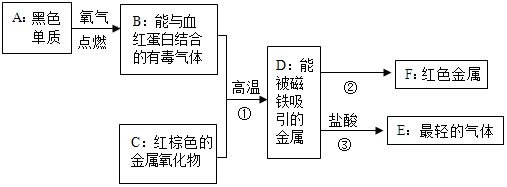

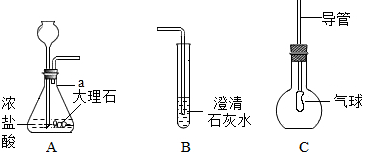 如图为某同学在实验室制取CO2并检验CO2性质的实验装置图.
如图为某同学在实验室制取CO2并检验CO2性质的实验装置图.