
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验探究题
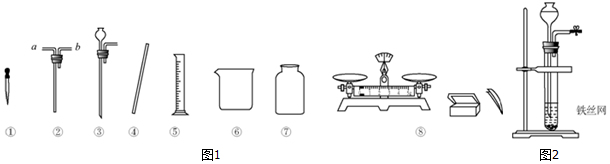
查看答案和解析>>
科目: 来源: 题型:填空题
| 名称 | 化学式 | 名称 | 化学式 |
| 2个碳酸分子 | 稀盐酸呈酸性的微粒 | ||
| 3个氢氧根离子 | 含有氮元素的碱 | ||
| 溶于水,溶液温度明显降低 | 作建筑材料,制玻璃的物质 | ||
| 因发生物理变化溶液质量增大 | 地壳中含量最多的金属 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 鉴别棉线与羊毛绒-灼烧闻气味 | |
| B. | 除去氧化钙中的碳酸钙-高温煅烧 | |
| C. | 区分氯化铵与氯化钠-加熟石灰 | |
| D. | 检验氢氧化钠溶液是否变质-滴入酚酞溶液 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
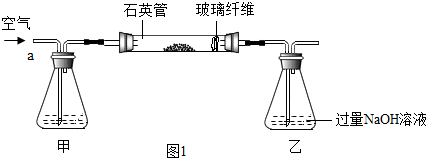


查看答案和解析>>
科目: 来源: 题型:实验探究题
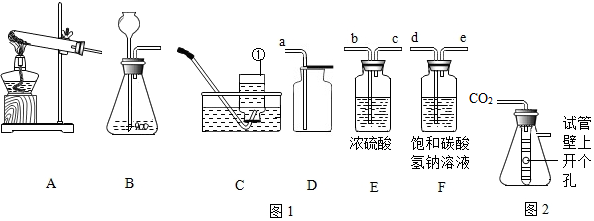
查看答案和解析>>
科目: 来源: 题型:推断题
 通过化学学习,同学们对物质的组成和结构有了一定的了解.
通过化学学习,同学们对物质的组成和结构有了一定的了解.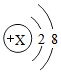 ,则X=8.
,则X=8.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com