
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
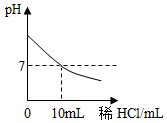 在进行稀盐酸和氢氧化钠溶液中和反应实验时,若要使反应过程中的酸碱度变化如图所示,则:
在进行稀盐酸和氢氧化钠溶液中和反应实验时,若要使反应过程中的酸碱度变化如图所示,则:查看答案和解析>>
科目: 来源: 题型:选择题
| 物质(括号内为杂质) | 除杂试剂 | 分离方法 | |
| A | Fe( Cu ) | HCl溶液 | 溶解、过滤、洗涤、烘干 |
| B | CO2( CO ) | O2 | 点燃 |
| C | CuO( C ) | -- | 隔绝空气加强热 |
| D | FeCl2(CuCl2) | Fe | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:计算题
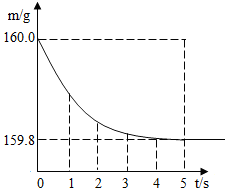 小李要测定某Cu-Zn合金中铜的质量分数,做了如下实验.
小李要测定某Cu-Zn合金中铜的质量分数,做了如下实验.查看答案和解析>>
科目: 来源: 题型:解答题
 如图是A、B、C三种固体物质的溶解度曲线,根据该图回答下列问题.
如图是A、B、C三种固体物质的溶解度曲线,根据该图回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com