
科目: 来源: 题型:解答题
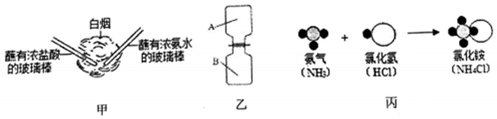
查看答案和解析>>
科目: 来源: 题型:解答题
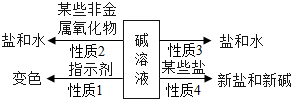 归纳总结是学习的一种方法,请结合小娇同学对碱的四点化学性质的归纳图完成下列问题:(箭头上方的物质是指与碱反应的物质).
归纳总结是学习的一种方法,请结合小娇同学对碱的四点化学性质的归纳图完成下列问题:(箭头上方的物质是指与碱反应的物质).查看答案和解析>>
科目: 来源: 题型:解答题
| 营养成分 | 水分 | 蛋白质 | 脂肪 | 糖类 | X | 钙、磷、铁、锌 |
| 质量 | 92.5g | 0.7g | 0.2g | 6.1g | 6.8mg | 17.1mg |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
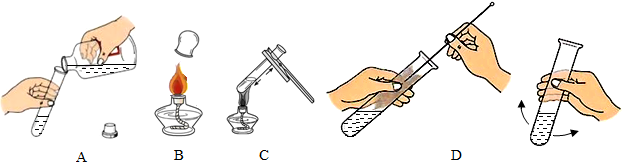
查看答案和解析>>
科目: 来源: 题型:实验探究题
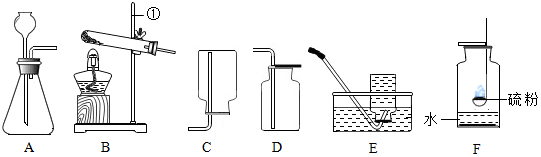
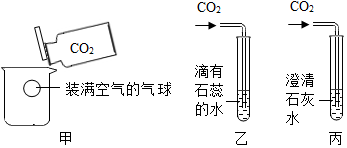
查看答案和解析>>
科目: 来源: 题型:实验探究题
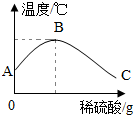 学习酸碱中和反应时,很多同学对其产生了探究兴趣.
学习酸碱中和反应时,很多同学对其产生了探究兴趣.查看答案和解析>>
科目: 来源: 题型:解答题

| 温度/℃ | 0 | 40 | 80 |
| Ca(OH)2溶解度/g | 0.187 | 0.141 | 0.094 |
| Ba(OH)2溶解度/g | 1.67 | 8.22 | 101.4 |
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:解答题
| 加入的试剂 | 测得的数据 | |
| 方法1 | 足量BaCl2溶液 | BaCO3沉淀1.97g |
| 方法2 | 足量稀硫酸 | CO2气体0.44g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com