
科目: 来源: 题型:实验探究题
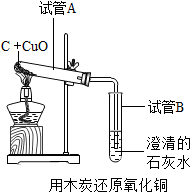 对于化学反应,我们不但要考虑加入的试剂,还要考虑环境中的其他物质对化学反应的影响.教材中“木炭还原氧化铜”的实验(见图).
对于化学反应,我们不但要考虑加入的试剂,还要考虑环境中的其他物质对化学反应的影响.教材中“木炭还原氧化铜”的实验(见图).查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 实验现象 |
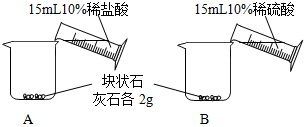 | A中不断产生气泡,固 体逐渐减少,有少量固体 剩余. B中开始有少量气泡产 生,反应很快停止. |
| 实验步骤 | 实验现象 |
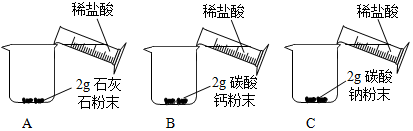 | A中迅速产生大量 气泡,固体很快减少, 有少量固体剩余. B、C中都迅速产生 大量气泡,固体很快 消失. |
查看答案和解析>>
科目: 来源: 题型:实验探究题

| 浓度 时间(min) 条件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入a g Fe2O3 | 7.0 | 9.0 | 16.0 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:填空题
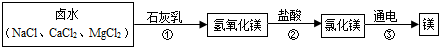
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com