
科目: 来源: 题型:计算题
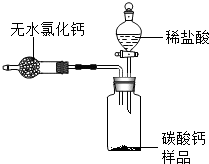 为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):查看答案和解析>>
科目: 来源: 题型:计算题
 生活中科学之美、科学之趣随处可见.如图是某厂商设计的T恤,T恤上有趣的图案是邻二溴苯(C6H4Br2)分子的结构简式.
生活中科学之美、科学之趣随处可见.如图是某厂商设计的T恤,T恤上有趣的图案是邻二溴苯(C6H4Br2)分子的结构简式.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 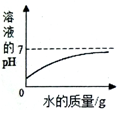 向氢氧化钠溶液中滴加足量的水 | |
| B. | 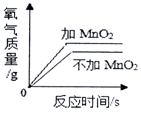 两份等体积的5%过氧化氢溶液,向其中一份加入少量二氧化锰 | |
| C. | 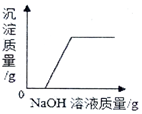 向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液 | |
| D. | 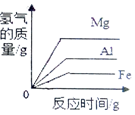 等质量的不同金属分别放入到足量的相同稀盐酸 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
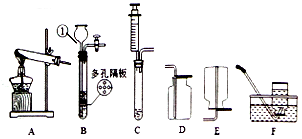 根据如图回答问题:
根据如图回答问题: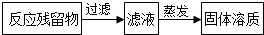 ,过滤所用的玻璃仪器除烧杯、漏斗外,还有玻璃棒(填仪器名称),在蒸发过程中,当蒸发皿中出现较多量固体时,停止加热,利用蒸发皿的余热使滤液蒸干.
,过滤所用的玻璃仪器除烧杯、漏斗外,还有玻璃棒(填仪器名称),在蒸发过程中,当蒸发皿中出现较多量固体时,停止加热,利用蒸发皿的余热使滤液蒸干.查看答案和解析>>
科目: 来源: 题型:推断题
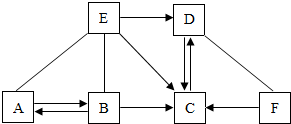 已知A、B、C、D、E分别是初中化学常见的五种不同类别的物质,其中A在工业上用于制玻璃,B的固体和E的浓溶液常用作实验室的干燥剂,F是一种黑色固体,它们之间存在如图所示的关系(图中“-”表示两端的物质能反应,“→”表示物质间存在转化关系,部分物质和反应条件示标出).请按要求回答下列问题:
已知A、B、C、D、E分别是初中化学常见的五种不同类别的物质,其中A在工业上用于制玻璃,B的固体和E的浓溶液常用作实验室的干燥剂,F是一种黑色固体,它们之间存在如图所示的关系(图中“-”表示两端的物质能反应,“→”表示物质间存在转化关系,部分物质和反应条件示标出).请按要求回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
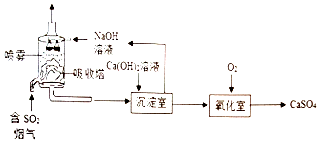
查看答案和解析>>
科目: 来源: 题型:填空题
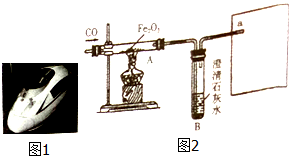 江西即将迎来高铁时代,赣州到南昌的高铁将于2019年建成,届时赣州到南昌只需2小时.
江西即将迎来高铁时代,赣州到南昌的高铁将于2019年建成,届时赣州到南昌只需2小时.查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com