
科目: 来源: 题型:选择题
| A. | 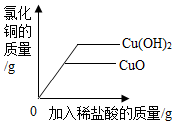 等质量的Cu(OH)2和CuO分别加入相同的稀盐酸 | |
| B. | 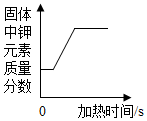 加热氯酸钾和二氧化锰的混合物制氧气 | |
| C. |  生石灰中加入一定质量的水 | |
| D. | 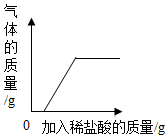 部分变质的氢氧化钠溶液中加入稀盐酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由碳、氢、氧三种元素组成 | |
| B. | 氢元素的质量分数最大 | |
| C. | 属于氧化物 | |
| D. | 由6个碳原子、12个氢原子和6个氧原子构成 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
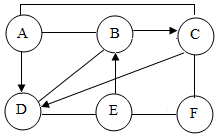 现有A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,且B气体在同等条件下是密度最小的气体,C常用作导线的内部材料,C和D含有相同元素,E是一种溶液,溶质是由两种元素组成的化合物,用两圆间的“──”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质.请回答下列问题:(以上反应均在初中知识范围内)
现有A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,且B气体在同等条件下是密度最小的气体,C常用作导线的内部材料,C和D含有相同元素,E是一种溶液,溶质是由两种元素组成的化合物,用两圆间的“──”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质.请回答下列问题:(以上反应均在初中知识范围内)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通过闻气味区别厨房中的醋和白酒 | |
| B. | 往溶液中滴加氯化钡溶液有白色沉淀,该沉淀一定是BaSO4 | |
| C. | 加入足量稀盐酸可以除去硫酸镁溶液中混有少量的氧化镁 | |
| D. | 降温某溶液有晶体析出,该原溶液一定是饱和溶液 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验装置 | 实验现象 |
 | 1号试管中无明显现象 |
| 2号试管中无明显现象 | |
| 3号试管中有气泡生成 | |
| 4号试管中有白色沉淀产生 |
| 实验装置 | 实验现象 |
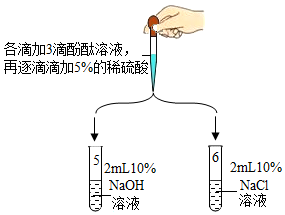 | 5号试管中,滴加酚酞溶液后,溶液由无色变为红色;滴加一定量稀硫酸后,溶液由红色变为无色 |
| 6号试管中始终无明显现象 |
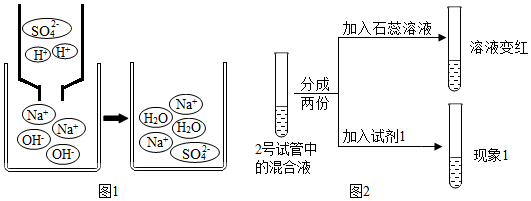
查看答案和解析>>
科目: 来源: 题型:解答题
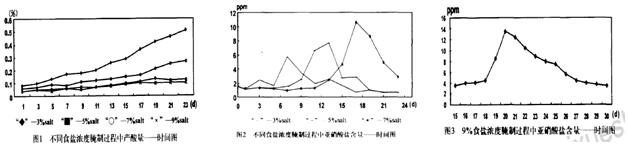
查看答案和解析>>
科目: 来源: 题型:解答题
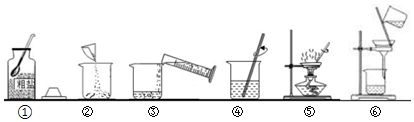
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com