
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
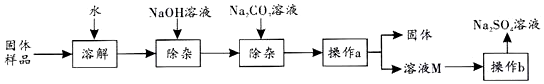
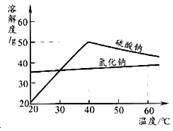
查看答案和解析>>
科目: 来源: 题型:填空题
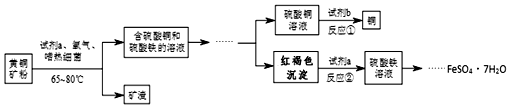
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验探究题

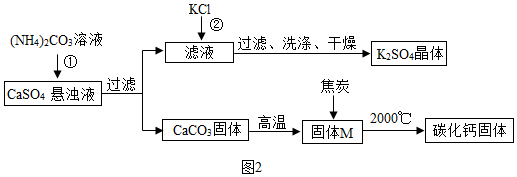

查看答案和解析>>
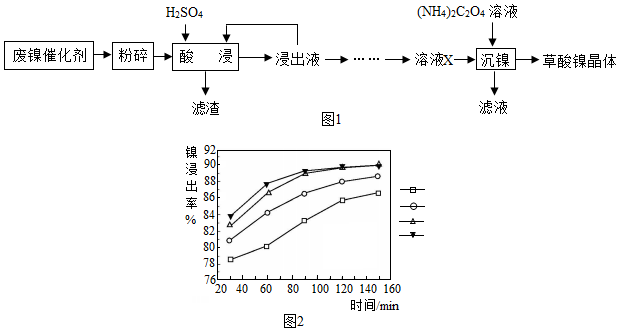
科目: 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Ni2+ | 6.7 | 9.5 |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 途径②比途径①更好地体现绿色化学思想 | |
| B. | 途径①中80g铜与200g98%浓硫酸反应可得到160g硫酸铜 | |
| C. | 反应③分解所得混合气体X的成分是SO2和SO3 | |
| D. | 若步骤4中所得沉淀为Cu(OH)2和CuSO4•3 Cu(OH)2,则沉淀中铜元素含量较CuSO4中铜元素含量大 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com