
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 所用试剂和操作方法 |
| A | Na2CO3溶液 | Na2SO4溶液 | 加入过量的Ba(NO3)2溶液,过滤 |
| B | H2 | HCl | 加饱和的NaHCO3溶液,浓硫酸 |
| C | NaCl固体 | 细沙 | 加足量的水溶解、过滤,蒸发结晶 |
| D | 铁粉 | Fe2O3 | 加入适量的稀盐酸,过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
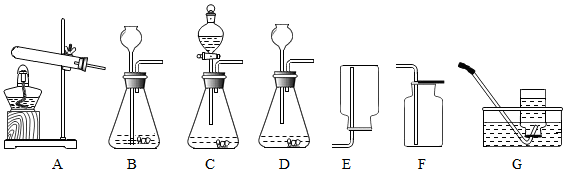
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 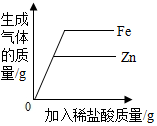 向等质量的锌、铁中滴加等质量分数的稀盐酸 | |
| B. |  将一定质量的硝酸钾不饱和溶液恒温蒸发水分,直到有晶体析出 | |
| C. |  质量相同的KClO3中加入催化剂(MnO2)与不加入催化剂加热制取O2 | |
| D. |  碳和氧化铜的固体混合物在高温条件下反应 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
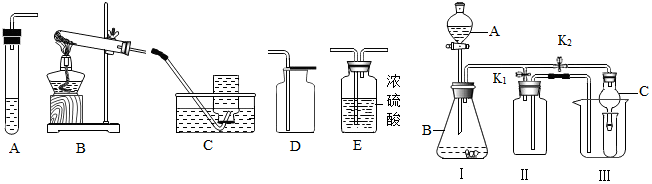
| 制取气体 | 所需要品 | 装置连接顺序 | 反应化学方程式 |
| 干燥的二氧化碳 | 大理石和稀盐酸 | AED | CaCO3+2HCl=CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
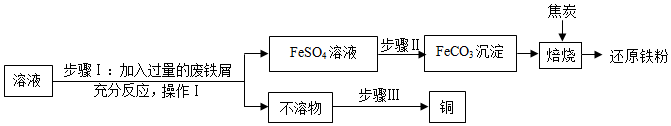
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 1.14 | 3.0 |
| Fe2+ | 5.85 | 8.35 |
| Al3+ | 3.0 | 4.7 |
查看答案和解析>>
科目: 来源: 题型:计算题
| 称量项目 | 甲 | 乙 | 丙 |
| 所取样品的质量/g | 15 | 15 | 20 |
| 加入氯化钡溶液的质量/g | 150 | 100 | 100 |
| 反应后所得沉淀的质量/g | 23.3 | 23.3 | 23.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com