
科目: 来源: 题型:选择题
| A. | 工业废水需要处理达标后才能排放 | |
| B. | 明矾可以使硬水转化为软水 | |
| C. | 蒸馏海水和电解水的过程中水发生的都是物理变化 | |
| D. | 蒸馏水、自来水都是纯净物 |
查看答案和解析>>
科目: 来源: 题型:解答题
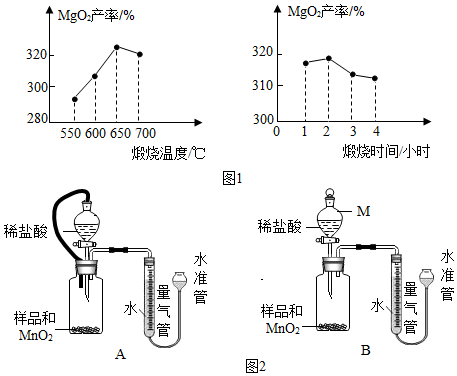
查看答案和解析>>
科目: 来源: 题型:填空题
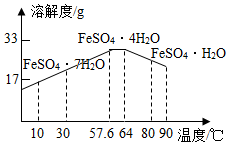 某工厂以含有FeSO4和少量H2SO4的废水为原料制备FeSO4•7H2O的步骤如下:
某工厂以含有FeSO4和少量H2SO4的废水为原料制备FeSO4•7H2O的步骤如下:查看答案和解析>>
科目: 来源: 题型:多选题
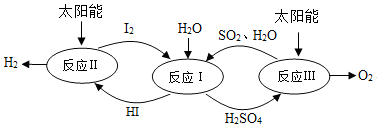
| A. | 反应过程中化合价改变的元素有H、O、S、I | |
| B. | 涉及的反应类型有分解反应和化合反应 | |
| C. | 理论上,每生成16gO2,就能得到2gH2 | |
| D. | 理论上,每分解18gH2O,就需向体系内再补充32gSO2 |
查看答案和解析>>
科目: 来源: 题型:计算题
| 实验组别 | 一 | 二 | 三 | 四 |
| 稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
| 混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
| 所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
| 剩余固体质量/g | 0 | 0 | m | n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com