
科目: 来源: 题型:选择题
| A. | 蒸发5g水有固体溶质析出 | B. | 加入少许硝酸钾晶体不溶 | ||
| C. | 把溶液降温至0℃有固体溶质析出 | D. | 升高温度能继续溶解晶体 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:解答题
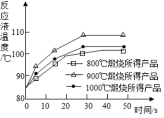
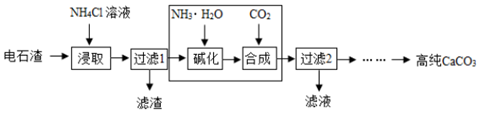
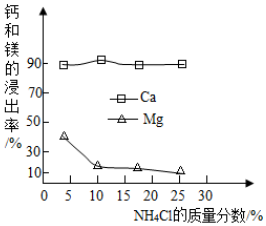
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | δ-Fe、γ-Fe、α-Fe之间的相互转化是化学变化 | |
| B. | δ-Fe、γ-Fe、α-Fe一定不属于同种元素 | |
| C. | δ-Fe、γ-Fe、α-Fe属于同种物质 | |
| D. | δ-Fe、γ-Fe、α-Fe三种铁单质的性质都相同 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
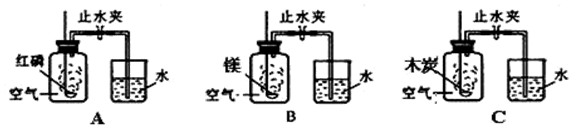
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 样品中只混有KCl | B. | 样品中有NaHCO3,也有Ba(NO3)2 | ||
| C. | 样品中一定混有KCl,可能有NaHCO3 | D. | 样品中一定混有NaHCO3,可能有KCl |
查看答案和解析>>
科目: 来源: 题型:选择题
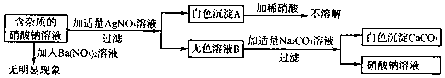
| A. | 无色溶液B的溶质是硝酸钙 | |
| B. | 原溶液中的杂质只有氯化钙 | |
| C. | 原溶液中的杂质只有硝酸钙和氯化钠二种物质组成 | |
| D. | 该实验中涉及的基本反应类型只有一种 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 溶质质量分数 | 2% | 2% | 2% | 6% | 6% | 6%] | 10% | 10% | 10% |
| 水的温度(℃) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 40 | 60 |
| 溶液pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | 11.46 | 11.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com