
科目: 来源: 题型:实验探究题
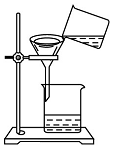 小红同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用如图所示装置进行过滤,请问:
小红同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用如图所示装置进行过滤,请问:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用泡沫灭火器扑灭 | B. | 找老师一起想办法 | ||
| C. | 用湿抹布扑灭 | D. | 用自来水浇灭 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 装置甲:制NH3 | B. | 装置乙:制NaHCO3 | ||
| C. | 装置丙:分离NaHCO3 | D. | 装置丁:干燥NaHCO3 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 该反应不符合复分解反应发生的条件 | |
| B. | 该反应中四种物质都是盐 | |
| C. | 反应后可用过滤的方法分离出NaHCO3 | |
| D. | 反应后的溶液中不能继续溶解NaCl |
查看答案和解析>>
科目: 来源: 题型:解答题
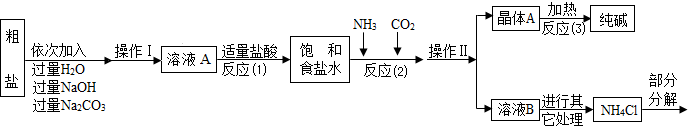
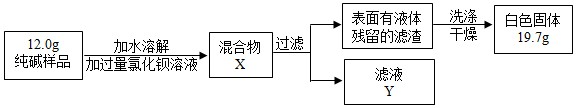
查看答案和解析>>
科目: 来源: 题型:解答题
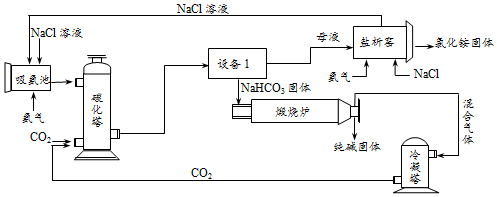
查看答案和解析>>
科目: 来源: 题型:解答题
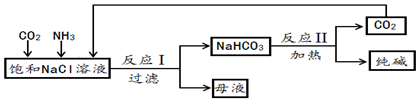
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜用于制导线,是由于铜有良好的导电性 | |
| B. | 二氧化碳能够灭火,是由于其不燃烧、不支持燃烧,且密度比空气大 | |
| C. | 氮气常用作保护气,是由于氮气的化学性质稳定 | |
| D. | 铁制品表面涂“银粉”(铝粉),是由于铝的化学性质比铁稳定 |
查看答案和解析>>
科目: 来源: 题型:解答题
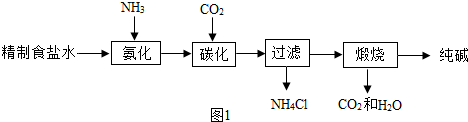
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com