
科目: 来源: 题型:实验探究题
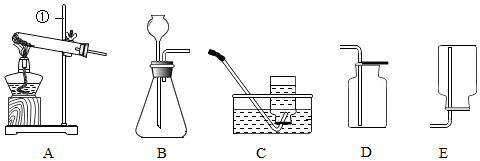
| 实验操作 | 实验现象 | 实验结论 |
| 取少量反应后的废液于试管中,加入足量Na2CO3(填化学式)溶液,振荡. | 大量气泡 | 猜想②正确 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
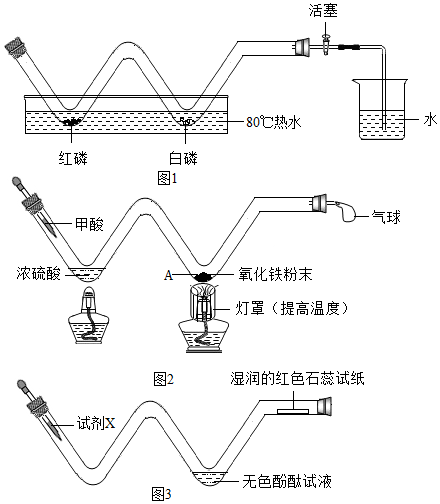
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验探究题
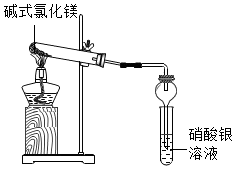 碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究.
碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究.查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:计算题
| 实验序号 | 温度(℃) | 大理石颗粒 | 盐酸质量分数(%) | 实验目的 |
| 1 | 20 | 粗 | 5 | 探究大理石和盐酸的反应速度与石灰石颗粒大小的关系 |
| 2 | 20 | 细 | 5 |
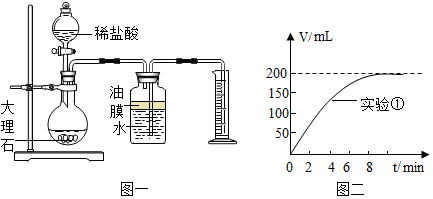
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | -1、-1 | B. | -2、-2 | C. | -1、-2 | D. | -2、-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用量筒量取一定量的水,读数时要平视液体凹形液面中央最低处 | |
| B. | 制作糖水时候,用玻璃棒搅拌可以加快糖的溶解 | |
| C. | 在用烧杯配制氢氧化钠溶液时,将氢氧化钠溶于水,会感觉烧杯壁比较热 | |
| D. | 因为氯化钠没有腐蚀性,所以可以直接在托盘天平上称量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com