
科目: 来源: 题型:解答题
| 甲 | 乙 | 丙 |
| Ba(OH)2、NaOH | NaCl、Na2CO3 | HCl、NaCl |
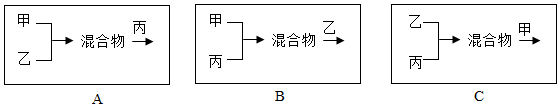 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 溶液变为不饱和溶液 | B. | 溶液仍是饱和溶液 | ||
| C. | 溶质的溶解度减小 | D. | 溶液中溶剂质量不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生铁中的含碳量大于钢中的含碳量 | |
| B. | 不锈钢可用于制造医疗器械 | |
| C. | 铁是地壳中含量最多的金属元素 | |
| D. | 回收利用是保护金属资源的有效途径之一 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
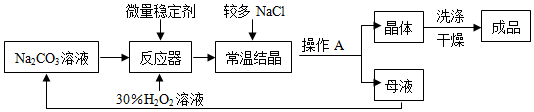
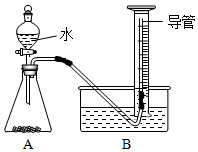
查看答案和解析>>
科目: 来源: 题型:推断题
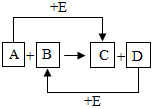 现有A、B、C、D、E五种初中化学常见的物质,已知A、B是氧化物,C是一种紫红色金属单质,A、B、C、D、E它们之间的转化关系如图所示,反应条件均已略去.
现有A、B、C、D、E五种初中化学常见的物质,已知A、B是氧化物,C是一种紫红色金属单质,A、B、C、D、E它们之间的转化关系如图所示,反应条件均已略去.查看答案和解析>>
科目: 来源: 题型:填空题
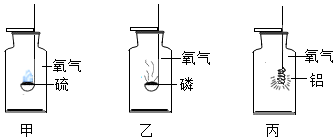
查看答案和解析>>
科目: 来源: 题型:解答题
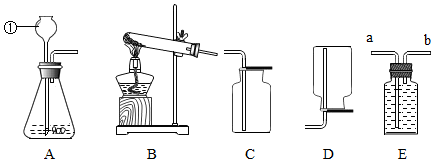
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com