
科目: 来源: 题型:选择题
| A. | 6.0 克 | B. | 5.6 克 | C. | 16 克 | D. | 6.4 克 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 次数 | 实验前 | 第1次 | 第2次 |
| 加入稀盐酸的质量/g | 0 | 50 | 50 |
| 剩余固体的质量/g | 5 | 3 | 2 |
| A. | 第 1 次加入稀盐酸后剩余固体中还有镁 | |
| B. | 第 2 次所加入的稀盐酸未反应完 | |
| C. | 每 50 g 稀盐酸和 1 g 镁恰好完全反应 | |
| D. | 合金样品中铜的质量分数为 40% |
查看答案和解析>>
科目: 来源: 题型:计算题

查看答案和解析>>
科目: 来源: 题型:填空题
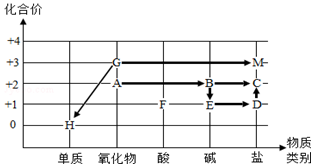 同学们依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化).
同学们依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 盐中含有金属离子和酸根离子,NH4NO3中没有金属离子,所以它不属于盐类 | |
| B. | 离子是带电的原子或原子团,所以带电的粒子就是离子 | |
| C. | 化学反应前后由于原子种类不变,所以元素种类也不变 | |
| D. | 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 室温 | 100 | 550 | 1400 |
| B装置/g | 200.00 | 201.80 | 205.04 | 205.04 |
| C中铜网/g | 100.00 | 100.00 | 100.00 | 101.28 |
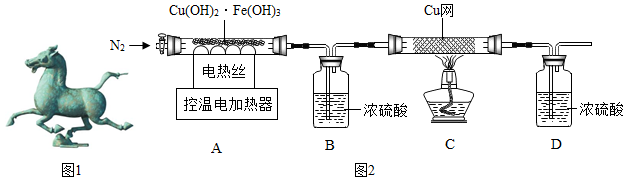
查看答案和解析>>
科目: 来源: 题型:推断题
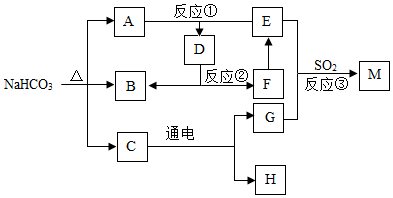 如图为某些物质间的转化关系.E为常见的碱,F常作食品干燥剂,M为石膏的主要成分.部分反应物和生成物已略去.
如图为某些物质间的转化关系.E为常见的碱,F常作食品干燥剂,M为石膏的主要成分.部分反应物和生成物已略去.查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com