
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:解答题
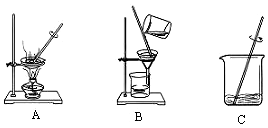
查看答案和解析>>
科目: 来源: 题型:实验探究题
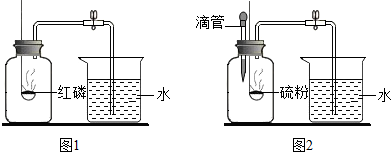 “空气中氧气含量的测定”有多种方法.甲生设计了如图1如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:
“空气中氧气含量的测定”有多种方法.甲生设计了如图1如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
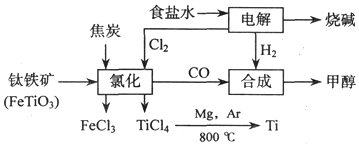
| A. | 氯化过程反应为:2FeTiO3+6C+7Cl2$\frac{\underline{\;一定条件\;}}{\;}$2FeCl3+2TiCl4+6CO | |
| B. | 由流程示意图分析,该冶炼Ti法对环境友好 | |
| C. | TiCl4转化为Ti反应中,氩气(Ar)作保护气,反应类型为置换反应 | |
| D. | 钛铁矿学名叫钛酸亚铁(FeTiO3),由此可推知其中钛元素为+3价 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
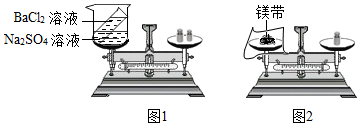
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com